
| A. | 22.4 L O2中一定含有6.02×1023个氧分子 | |
| B. | 将80 g NaOH 溶于1L 水中,所得溶液中NaOH 的物质的量浓度为2mol/L | |
| C. | 18 g 水在标准状况下的体积为22.4 L | |
| D. | 在标准状况下,20 ml NH3与60 ml O2所含的分子数之比为1:3 |
分析 A.没有告诉在标准状况下,不能使用22.4L/mol计算;
B.物质的量浓度中,体积为溶液体积;
C.气体摩尔体积使用对象为气体;
D.相同条件下,气体体积之比等于其分子数目之比.
解答 解:A.不是标准状况下,无法计算11.2L氮气的物质的量,故A错误;
B.将80克NaOH溶于1L水中,氢氧化钠的物质的量为2mol,但是溶液的体积大于1L,所以所得溶液的物质的量浓度小于2mol/L,故B错误;
C.标准状况下,水是液体,不能使用气体摩尔体积,故C错误;
D.同温同压下,气体体积之比等于其分子数目之比,故标准状况时,20mLNH3与60mL O2所含的分子个数比=20mL:30mL=1:3,故D正确;
故选D.
点评 本题考查物质的量的计算,题目难度不大,掌握好以物质的量为中心的各化学量与阿伏加德罗常数的关系是解题关键,注意气体摩尔体积使用条件和对象,B为易错点,注意物质的量浓度中体积为溶液的体积.


科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Ⅰ中溶液分层,下层呈紫红色 | B. | Ⅱ中溶液分层,下层呈紫红色 | ||
| C. | Ⅲ中溶液分层,下层呈棕黄色 | D. | Ⅳ中溶液不分层,溶液没有颜色 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 只有①② | B. | 只有①③ | C. | 只有②③ | D. | ①②③ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Cu2+ Fe2+ NO3- Cl- | B. | K+ Mg2+HCO3-SO42- | ||
| C. | S2- Na+ K+、Cl- | D. | Ba2+Na+ I- NO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用胶头滴管向试管滴液体时,滴管尖端与试管内壁 | |
| B. | 过滤操作中,漏斗颈与烧杯内壁 | |
| C. | 分液操作中,分液漏斗颈与烧杯内壁 | |
| D. | 过滤操作中,玻璃棒与三层滤纸 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 钢铁发生电化腐蚀的负极反应式:Fe-3e-═Fe3+ | |
| B. | 氢氧燃料电池的正极反应式:O2+2H2O+4e-═4OH- | |
| C. | 铜上镀锌时,与电源正极相连的是纯铜 | |
| D. | 用惰性电极电解饱和食盐水时,阴极的电极反应式为:2Cl--2e-═Cl2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
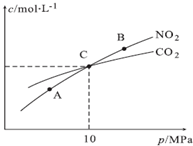 氮的化合物在生产生活中广泛存在.
氮的化合物在生产生活中广泛存在.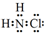 .可通过反应NH3(g)+Cl2(g)=NH2Cl(g)+HCl(g)制备氯胺,已知部分化学键的键能如表所示(假定不同物质中同种化学键的键能一样),则上述反应的△H=+11.3kJ•mol-1.
.可通过反应NH3(g)+Cl2(g)=NH2Cl(g)+HCl(g)制备氯胺,已知部分化学键的键能如表所示(假定不同物质中同种化学键的键能一样),则上述反应的△H=+11.3kJ•mol-1.| 化学键 | 键能/(kJ•mol-1) |
| N-H | 391.3 |
| Cl-Cl | 243.0 |
| N-Cl | 191.2 |
| H-Cl | 431.8 |
| t/min | 0 | 40 | 80 | 120 | 160 |
| n(NO)(甲容器)/mol | 2.00 | 1.50 | 1.10 | 0.80 | 0.80 |
| n(NO)(乙容器)/mol | 1.00 | 0.80 | 0.65 | 0.53 | 0.45 |
| n(NO)(丙容器)/mol | 2.00 | 1.45 | 1.00 | 1.00 | 1.00 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com