
【题目】25℃时,取浓度均为0.1 mol·L1的醋酸溶液和氨水各20 mL,分别用0.1 mol·L1 氢氧化钠溶液和0.1 mol·L1盐酸进行中和滴定,滴定过程中pH随滴加溶液的体积变化关系如图所示。下列说法正确的是
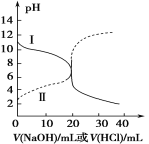
A.曲线I,滴加10 mL溶液时:c(NH4+)+c(H+)=c(OH-)+c(NH3·H2O)
B.曲线I,滴加20 mL溶液时:两溶液恰好完全反应,此时溶液的pH<7
C.曲线II,滴加溶液体积在10~20 mL之间时存在:c(NH4+)=c(Cl-)>c(OH-)=c(H+)
D.曲线II,滴加30 mL溶液时:c(CH3COO-)>c(Na+)>c(OH-)>c(H+)
【答案】B
【解析】
NaOH滴定醋酸,溶液的pH越来越大,因此虚线表示的NaOH滴定醋酸的曲线;而HCl滴定氨水时,pH越来越小,因此实现表示的为HCl滴定氨水的曲线。
A、实现表示的为HCl滴定氨水的曲线,加入10mL溶液,NH3·H2O反应掉一半,得到NH3·H2O和NH4Cl等浓度的混合溶液,根据物料守恒有c(NH4+)+c(NH3·H2O)=2c(Cl-);根据电荷守恒,有c(NH4+)+c(H+)=c(OH-)+c(Cl-),加入10mLHCl时,溶液呈碱性,说明NH3·H2O的电离大于NH4+的水解,则c(NH4+)>c(Cl-)>c(NH3·H2O),则c(NH4+)+c(H+)<c(OH-)+ c(Cl-),A错误;
B、恰好完全反应时,生成NH4Cl,为强酸弱碱盐,水解成酸性,pH<7,B正确;
C、曲线Ⅱ中,滴加溶液体积在10mL~20mL时,溶液的pH从酸性变成碱性,除了中性外c(OH-)≠c(H+),C错误;
D、曲线II,滴加30 mL溶液时,溶液呈碱性,c(OH-)>c(H+);根据电荷守恒c(CH3COO-)+c(OH-)=c(H+) +c(Na+),则c(Na+)> c(CH3COO-),D错误;
答案选B。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】下述实验方案能达到实验目的的是 ( )
编号 | A | B | C | D |
实验 |
|
|
|
|
实验 | 验证铁钉发生 | 验证Fe电极被保护 | 验证乙炔的还原性 | 验证甲烷与氯气发生 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A卷题.电子工业常用FeCl3溶液腐蚀绝缘板上的铜箔,制造印刷电路板。从腐蚀废液(主要含FeCl3、FeCl2、CuCl2 )中回收铜,并重新获得FeCl3溶液。废液处理流程如下:
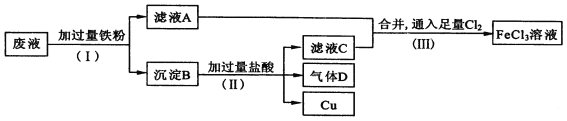
(1)步骤(Ⅰ)中分离溶液和沉淀的操作名称是____________________;
(2)沉淀B中主要含有铁和__________,气体D是_________________;
(3)写出步骤(Ⅲ)中生成FeCl3的化学方程式_____________________________;
(4)取少量最终所得溶液滴加____________(填“KSCN溶液”或“稀硫酸”),溶液呈红色,证明有Fe3+存在;写出该反应的离子方程式___________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中,正确的是
A.78g Na2O2固体含有离子的数目为4NA
B.由水电离出的c(H+)=1012mol·L1溶液中Na+、NH4+、SO42、NO3 一定能大量共存
C.硫酸酸化的KI淀粉溶液久置后变蓝的反应为:4I+O2+4H+=2I2+2H2O
D.将充有NO2的玻璃球浸到热水中气体颜色加深说明2NO2(g)![]() N2O4(g) △H >0
N2O4(g) △H >0
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有A、B、C、D四种短周期主族元素,它们的原子序数依次增大,其中A元素原子核外电子仅有一种原子轨道,也是宇宙中最丰富的元素,B元素原子的核外p轨道电子数比s轨道电子数少1,C为金属元素且原子核外p轨道电子数和s轨道电子数相等,D元素的原子核外所有p轨道全充满或半充满。
(1)写出四种元素的元素符号:A_______,B_______,C_______,D_______。
(2)写出C、D两种基态原子核外电子排布图:
C__________________________________;
D___________________________________。
(3)写出B、C两种元素的单质在一定条件下反应的化学方程式:_________。
(4)写出B元素单质和简单氢化物的电子式:单质____________,氢化物____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】盖斯定律在生产和科学研究中有很重要的意义。有些反应的反应热虽然无法直接测得,但可通过间接的方法测定。现根据下列3个热化学反应方程式:
Fe2O3(s)+3CO(g)="=" 2Fe(s)+3CO2(g) △H= ―24.8kJ/mol
3Fe2O3(s)+ CO(g)==2Fe3O4(s)+ CO2(g) △H= ―47.2kJ/mol
Fe3O4(s)+CO(g)==3FeO(s)+CO2(g) △H= +640.5kJ/mol
写出CO气体还原FeO固体得到Fe固体和CO2气体的热化学反应方程式:
_________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图,A池用石墨电极电解NaOH溶液,B池精炼粗铜,一段时间后停止通电,A池中D极产生具有氧化性的气体在标准状况下为2.24L。下列说法正确的是( )

A.A池为电解池,B池为原电池
B.D、E两极都发生氧化反应
C.E极应为粗铜板材料
D.B池中E极质量增加12.8g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某城市主要空气污染物为![]() 、
、![]() 、
、![]() 科学实验小组为检测空气样本成分,用蒸馏水处理制成待测液,设计实验及所得实验现象如下:
科学实验小组为检测空气样本成分,用蒸馏水处理制成待测液,设计实验及所得实验现象如下:
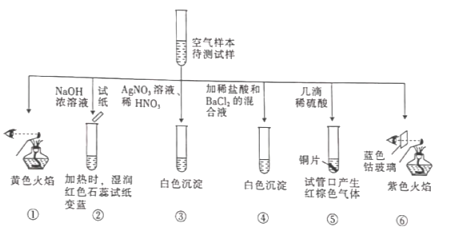
下列判断不正确的是
A.上述实验中可用![]() 代替
代替![]() ,以证明待测试样中含
,以证明待测试样中含![]()
B.由实验![]() 可知待测试样中含有
可知待测试样中含有![]() 和
和![]()
C.焰色反应表明待测试样中含Na元素和K元素
D.该城市的污染来源主要是燃煤和机动车尾气排放
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com