



分析 (1)大气中含有氧气,二氧化氮和水、氧气反应生成硝酸;
(2)①根据能量变化图计算反应热,反应热=反应物的键能和-生成物的键能和,从反应热可知该反应为吸热反应,升温平衡向吸热反应方向进行,根据生成物和反应物浓度变化确定平衡常数变化;
②升高温度,平衡向吸热反应方向移动,产生NOx的量大;
(3)①从图示可知,i中,参与捕集吸收NOx的物质是BaCO3;
②ii中,Ba(NO3)2释放NO同时生成氧气、氧化钡,据此书写方程式;
③NO被CO还原,则CO被NO氧化生成二氧化碳和氮气,据此写出反应方程式;
(4)①得电子的物质发生还原反应,失去电子的物质发生氧化反应;
②b极上NO得电子反应生成氮气.
解答 解:(1)大气中能氧化NO2的物质是氧气,二氧化氮和水、氧气反应生成硝酸,二氧化氮被氧化,反应离子方程式为:4NO2+O2+2H2O=4H++4NO3-,
故答案为:4NO2+O2+2H2O=4H++4NO3-;
(2)①反应热=反应物的键能和-生成物的键能和,图象中可知,该反应中的反应热=1443-1260=+183kJ/mol,所以N2和O2反应生成NO为吸热反应,升高温度,平衡向正反应方向移动,生成物浓度增大,反应物浓度减小,所以平衡常数增大,
故答案为:增大;
②反应生成NO的热化学反应方程式为N2(g)+O2(g)=2NO(g)△H=+183kJ/mol,热启动反应向生成NOx的方向进行,所以汽车在冷启动(温度较低时启动)产生NOx的量比热启动(温度较高时启动)产生的量小,
故答案为:小;
(3)①从图示可知,i中,BaCO3与NOx反应生成Ba(NO3)2,所以参与捕集吸收NOx的物质是BaCO3,
故答案为:BaCO3;
②ii中,Ba(NO3)2释放NO同时生成氧气、氧化钡,反应为:2Ba(NO3)2$\frac{\underline{\;一定条件\;}}{\;}$2BaO+4NO↑+3O2↑,
故答案为:2Ba(NO3)2$\frac{\underline{\;一定条件\;}}{\;}$2BaO+4NO↑+3O2↑;
③在催化剂条件下,一氧化碳被氧化生成二氧化碳,一氧化氮被还原生成氮气,所以其反应方程式为:2CO+2NO $\frac{\underline{\;催化剂\;}}{\;}$N2+2CO2;
故答案为:2CO+2NO $\frac{\underline{\;催化剂\;}}{\;}$N2+2CO2;
(4)①a极上氧离子失去电子生成氧气而被氧化,
故答案为:氧化;
②b极上NO得电子反应生成氮气,所以电极反应式为:2NO+4e-=N2+2O2-,
故答案为:2NO+4e-=N2+2O2-.
点评 本题综合考查汽车尾气处理,涉及化学反应方程式的书写、平衡常数,电化学等知识,提取题干中的信息是解答关键,题目难度中等,注意相关知识的积累.


 暑假作业暑假快乐练西安出版社系列答案
暑假作业暑假快乐练西安出版社系列答案科目:高中化学 来源: 题型:选择题
| 选项 | 反应类型 | 反应条件 |
| A | 加成、取代、消去 | KOH醇溶液/加热、KOH水溶液/加热、常温 |
| B | 消去、加成、取代 | NaOH醇溶液/加热、常温、KOH水溶液/加热 |
| C | 氧化、取代、消去 | 加热、KOH醇溶液/加热、KOH水溶液/加热 |
| D | 消去、加成、水解 | NaOH水溶液/加热、常温、NaOH醇溶液/加热 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
 肉桂酸是香料、化妆品、医药、塑料和感光树脂等的重要原料.实验室用下列反应制取肉桂酸.
肉桂酸是香料、化妆品、医药、塑料和感光树脂等的重要原料.实验室用下列反应制取肉桂酸.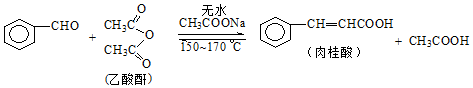
| 苯甲醛 | 乙酸酐 | 肉桂酸 | 乙酸 | |
| 溶解度(25℃,g/100g水) | 0.3 | 遇热水水解 | 0.04 | 互溶 |
| 沸点(℃) | 179.6 | 138.6 | 300 | 118 |

查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 由红外光谱可知,该有机物中至少有三种不同的化学键 | |
| B. | 由核磁共振氢谱可知,该有机分子中有三种不同化学环境的氢原子 | |
| C. | 仅由A的核磁共振氢谱可以得知其分子中的氢原子总数 | |
| D. | 若A的化学式为C2H6O,则其结构简式为CH3CH2OH |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 混合物 | 试剂 | 分离方法 | |
| A | 苯(苯酚) | 溴水 | 过滤 |
| B | 乙烷(乙烯) | 酸性高锰酸钾 | 洗气 |
| C | 乙酸乙酯(乙酸) | NaOH溶液 | 蒸馏 |
| D | 溴苯(液溴) | NaOH溶液 | 分液 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com