
| A. | 第一电离能:F>O>N | |
| B. | 离子晶体中一定存在离子键 | |
| C. | CCl4和NH3都是以极性键结合的极性分子 | |
| D. | 白磷为分子晶体,分子结构为正四面体,其键角为109.5° |
分析 A.同周期,随原子序数增大第一电离能增大,但N原子的2p电子半满为稳定结构;
B.离子键仅存在于离子化合物中;
C.CCl4为极性分子;
D.白磷键角为60°.
解答 解:A.同周期,随原子序数增大第一电离能增大,但N原子的2p电子半满为稳定结构,则第一电离能F>N>O,故A错误;
B.离子键仅存在于离子化合物中,离子晶体一定含有离子键,故B正确;
C.CCl4结构对称,正负电荷重心重叠,为非极性分子,故C错误;
D.白磷为分子晶体,分子结构为正四面体,但键角为60°,故D错误.
故选B.
点评 本题考查元素性质的比较,为高频考点,把握非金属性与电负性、第一电离能的关系及分子的极性、键角判断方法为解答的关键,侧重规律性知识的考查,注意元素周期表和周期律的应用,题目难度不大.


科目:高中化学 来源: 题型:实验题
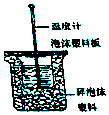 Ⅰ.50mL0.50mol/L盐酸与50mL0.55mol/LNaOH溶液在如图所示的装置中进行中和反应.通过测定反应过程中所放出的热量可计算中和热.回答下列问题.
Ⅰ.50mL0.50mol/L盐酸与50mL0.55mol/LNaOH溶液在如图所示的装置中进行中和反应.通过测定反应过程中所放出的热量可计算中和热.回答下列问题.| 实验用品 | 溶液温度 | |||
| t1 | t2 | |||
| ① | 50ml0.55mol/LNaOH | 50ml0.5mol/LHCl | 20℃ | 23.3℃ |
| ② | 50ml0.55mol/LNaOH | 50ml0.5mol/LHCl | 20℃ | 23.5℃ |
| 50ml0.55mol/LNaOH | 50ml0.5mol/LHCl | 20℃ | 21.5℃ | |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
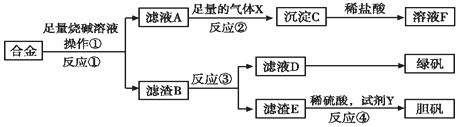
| 实验编号 | ① | ② | ③ | ④ |
| 稀硝酸体积(mL) | 100 | 200 | 300 | 400 |
| 剩余金属质量(g) | 9.0 | 4.8 | 0 | 0 |
| NO体积(L) | 1.12 | 2.24 | 3.36 | 4.48 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CO全部转化为乙醇 | |
| B. | 断4NA个H-H键的同时,生成46g乙醇 | |
| C. | 若反应在恒温密闭容器中进行,容器中混合气体的密度不再改变 | |
| D. | 若反应在绝热密闭容器中进行,容器中温度不再改变 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 再充入等物质的量的CO2和H2达到新的平衡状态,CO的体积分数不变 | |
| B. | 再向容器中再充入1molCO,平衡正向移动,H2的体积分数增大 | |
| C. | 若起始时充入1.2mol H2O(g)和0.6mol CO,达到平衡时H2的体积分数不变 | |
| D. | 若起始时充入0.9mol H2O(g)、0.6mol CO、0.7mol CO2和0.8molH2,则此时υ正=υ逆 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙烯中 C=C 的键能是乙烷中 C-C 的键能的 2 倍 | |
| B. | 同一原子中,2p,3p,4p 能级的轨道数目依次增多 | |
| C. | C-O 键的极性比 N-O 键的极性大 | |
| D. | 根据能量最低原理,原子的核外电子排布先填满离核近的轨道,再填充离核远的轨道 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 离子半径:W>Z>X | B. | 单质熔点:W>Z | ||
| C. | 最高正价:W>X>Y>Z | D. | 原子序数:Z>W>X>Y |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 物质 | 价格/元?吨-1 |
| 漂液(含25.2%NaClO) | 450 |
| 双氧水(含30%H2O2) | 2400 |
| 烧碱(含98%NaOH) | 2100 |
| 纯碱(含99.5%Na2CO3) | 600 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com