
| A. | 溶解 过滤 蒸发结晶 | B. | 加热 溶解 过滤 | ||
| C. | 溶解 过滤 蒸馏 | D. | 溶解 过滤 分液 |
科目:高中化学 来源: 题型:解答题
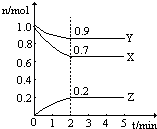 某温度时,在一个2L的密闭容器中,X、Y、Z三种物质的物质的量随时间的变化曲线如图所示.根据图中数据,试填写下列空白:
某温度时,在一个2L的密闭容器中,X、Y、Z三种物质的物质的量随时间的变化曲线如图所示.根据图中数据,试填写下列空白:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用渗析的方法精制氢氧化铁胶体 | |
| B. | SiO2、NaCl、I2、C2H6O均能真实表示物质分子组成 | |
| C. | “钴酞菁”分子(直径为1.3×10-9米)在水中形成的分散系能产生丁达尔效应 | |
| D. | 冰醋酸、铝热剂、硫酸钡、SO2分别属于酸、混合物、强电解质、非电解质 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
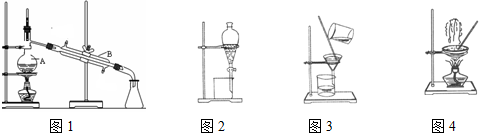
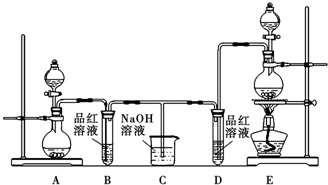
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | pH=12的溶液中:K+、Na+、AlO2-、CO32- | |
| B. | 在0.1mol•L-1的NaHCO3 溶液中:K+、Al3+、I-、Cl- | |
| C. | 与Al反应能放出H2的溶液中:Fe2+、K+、NO3-、SO42- | |
| D. | 使酚酞变红色的溶液中:Na+、Al3+、SO42-、Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
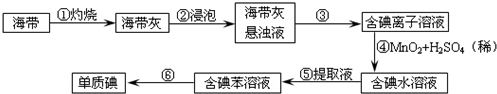
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 水的电离是一个吸热过程,温度升高,水的离子积KW也增大 | |
| B. | 当pH减少2个单位时,溶液中c(H+)增大20倍 | |
| C. | pH=2.0的酸溶液,稀释10倍时,pH为3 | |
| D. | 溶液稀释时,c(H+)减少,pH增大 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com