
| A. | ClO-中氯元素显+1价,具有很强的还原性 | |
| B. | 这些离子结合H+的能力,ClO4-最强 | |
| C. | ClO3-是NO3-的等电子体,其空间构型为平面三角形 | |
| D. | ClO2-、ClO3-、ClO4-中的氯原子都采取sp3杂化,离子中相邻两个Cl-O键间键角依次增大 |
分析 A.O元素的化合价为-2价,结合离子的电荷判断,且次氯酸根离子易得到电子;
B.酸性越强的酸,其结合氢离子能力越弱;
C.原子个数相等价电子数相等的微粒是等电子体;
D.根据价层电子对互斥理论确定其杂化方式.
解答 解:A.次氯酸根离子中氯元素是+1价,次氯酸根离子易得电子而体现较强的氧化性,故A错误;
B.酸性越强的酸,其结合氢离子能力越弱,高氯酸是最强的无机酸,所以ClO4-结合氢离子能力最弱,故B错误;
C.ClO3-和NO3-的价层电子数不同,所以不是等电子体,故C错误;
D.ClO2-、ClO3-、ClO4-中价层电子对数都是4,所以都采取sp3杂化,且孤对电子数分别为2、1、0,则离子中相邻两个Cl-O键间键角依次增大,故D正确;
故选D.
点评 本题考查含氯离子的结构,为高频考点,把握酸性、氧化性、等电子体、杂化类型为解答的关键,侧重分析与应用能力的考查,注意选项D为易错点,题目难度不大.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:解答题
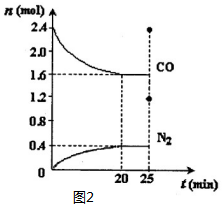 对含氮物质的研究和利用有着极为重要的意义.
对含氮物质的研究和利用有着极为重要的意义.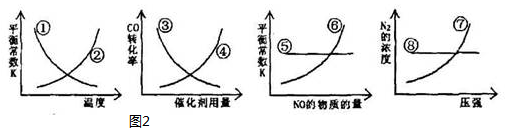
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 铁与稀硝酸反应:Fe+2H+═Fe2++H2↑ | |
| B. | 氢氧化铁溶液与盐酸反应:OH-+H+═H2O | |
| C. | 锌与硫酸铜溶液反应:Zn+Cu2+═Zn2++Cu | |
| D. | 氢氧化钡溶液与稀硫酸反应:H++SO42-+OH-+Ba2+═BaSO4↓+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
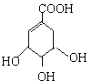 (提示:环丁烷
(提示:环丁烷 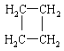 可简写成□)
可简写成□)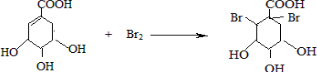 ,
,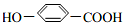 ),其反应类型是消去反应,
),其反应类型是消去反应,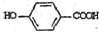 +2Br2→
+2Br2→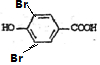 +2HBr.
+2HBr.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 石油分馏可以获得乙烯 | |
| B. | 煤经过气化和液化等物理变化可转化为淸洁燃料 | |
| C. | 聚乙烯塑料制品可用于食品包装 | |
| D. | 天然气和液化气的主要成分都是甲烷 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 相同物质的量浓度的NaA、HA混合溶液呈碱性 | |
| B. | 提高CO2兖气压力,碳酸饮料中c (A-)减小 | |
| C. | 当碳酸饮料的pH为5.0时,$\frac{c(HA)}{c({A}^{-})}$=0.16 | |
| D. | 碳酸饮料中各粒子的浓度关系为c( H+)=c( HCO3-)+2c( CO32-)+c(OH-)-c(HA) |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com