
【题目】某温度时在2L容器中X、Y、Z三种气体物质的物质的量(n)随时间(t)变化的曲线如图所示,由图中数据

(1)该反应的化学方程式为:___。
(2)反应开始至2min,用Z表示的平均反应速率为:___。
(3)下列叙述能说明上述反应达到化学平衡状态的__(填序号):
A.混合气体的总物质的量不随时间的变化而变化
B.混合气体的压强不随时间的变化而变化
C.单位时间内每消耗3molX,同时生成2molZ
D.混合气体的总质量不随时间的变化而变化
(4)在密闭容器里,通入amolX(g)和bmolY(g),发生反应X(g)+Y(g)═2Z(g),当改变下列条件时,反应速率会发生什么变化(选填“增大”、“减小”或“不变”)?
①降低温度:__;②恒容通入氦气:___;③使用催化剂:___。
【答案】3X+Y![]() 2Z 0.05mol/(Lmin) AB 减小 不变 增大
2Z 0.05mol/(Lmin) AB 减小 不变 增大
【解析】
(1)根据图象知,随着反应的进行,X、Y的物质的量减少,Z的物质的量增加,所以X、Y是反应物,Z是生成物;同一反应、同一时间段内,各物质的浓度变化量之比等于其计量数之比,0-2min时,△X=(1-0.7)mol=0.3mol,△Y=(1-0.9)mol=0.1mol,△Z=0.2mol-0=0.2mol,△X:△Y:△Z=0.3mol:0.1mol:0.2mol=3:1:2;
故该反应的化学方程式为:3X+Y2Z;
(2)反应开始至2min,用Z表示的平均反应速率为![]() =
=![]() =
= =0.05mol /(Lmin);
=0.05mol /(Lmin);
(3)A.混合气体的总物质的量不随时间的变化而变化,说明各物质的量不变,达平衡状态,选项A正确;
B.混合气体的压强不随时间的变化而变化,说明混合气体的总物质的量不随时间的变化而变化,说明各物质的量不变,达平衡状态,选项B正确;
C.单位时间内每消耗3mol X,同时生成2mol Z,只要反应发生就符合这个关系,选项C错误;
D.混合气体的总质量一直不随时间的变化而变化,选项D错误;
E. 恒定容积,混合气体的密度始终不变,选项E错误;
答案选AB;
(4)①温度越高,反应速率越快,所以降低温度,反应速率减小;
②保持容器体积不变,充入不参加反应的惰性气体,反应体系中各物质的量浓度不变,反应速率不变;
③使用催化剂,正逆反应速率均增大。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】25℃时,向10 mL 0.01mol·L-1NaCN溶液中逐滴加入0.01mol·L-1的盐酸,溶液中CN-、HCN物质的量分数(δ)随pH变化的关系如图甲所示,其中a点的坐标为(9.5,0.5)。溶液的pH变化曲线如图乙所示。下列溶液中的关系正确的是
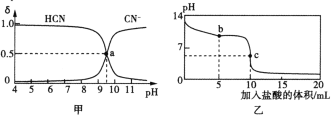
A.图甲中pH=7的溶液:c(Cl-)<c(HCN)
B.常温下,NaCN的水解平衡常数:Kh(NaCN)=10-4.5mol·L-1
C.图乙中b点的溶液:c(HCN)>c(Cl-)>c(CN-)>c(OH-)>c(H+)
D.图乙中c点的溶液:c(Na+)+c(H+)=c(HCN)+c(OH-)+c(CN-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某研究小组对碘化钾溶液在空气中发生氧化反应的速率进行实验探究。
(初步探究)
示意图 | 序号 | 温度 | 试剂A | 现象 |
| ① | 0℃ |
|
|
② | 20℃ |
| ||
③ | 20℃ |
|
| |
④ | 20℃ | 蒸馏水 |
|
(1)为探究温度对反应速率的影响,实验②中试剂A应为_________。
(2)写出实验③中![]() 反应的离子方程式:_________________。
反应的离子方程式:_________________。
(3)对比实验②③④,可以得出结论:_________________。
(继续探究)溶液![]() 对反应速率的影响
对反应速率的影响
查阅资料:i.![]() 时,
时,![]() 能被
能被![]() 氧化为I2。
氧化为I2。
ii.![]() 时,
时,![]() 发生歧化反应:
发生歧化反应:![]() ,
,![]() 越大,歧化速率越快。
越大,歧化速率越快。
(4)小组同学用4支试管在装有![]() 的储气瓶中进行实验,装置如图所示。
的储气瓶中进行实验,装置如图所示。
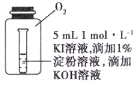
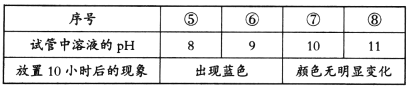
分析⑦和⑧中颜色无明显变化的原因:________。
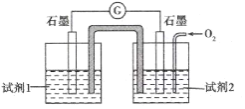
(5)甲同学利用原电池原理设计实验证实![]() 的条件下确实可以发生
的条件下确实可以发生![]() 被
被![]() 氧化为I2的反应,如图所示,请你填写试剂和实验现象____________。
氧化为I2的反应,如图所示,请你填写试剂和实验现象____________。
(深入探究)较高温度对反应速率的影响
小组同学分别在敞口试管和密闭试管中进行了实验⑨和⑩。
序号 | 温度 | 试剂 | 现象 |
⑨敞口试管 | 水浴70°C |
|
|
⑩密闭试管 | 溶液迅速出现黄色,且黄色逐渐加深,冷却至室温后滴加淀粉溶液出现蓝色 |
(6)对比实验⑨和⑩的现象差异,该小组同学经过讨论对实验⑨中的现象提出两种假设,请你补充假设1。
假设1:_____________。
假设2:45℃以上I2易升华,70℃水浴时,![]() 太小难以显现黄色。
太小难以显现黄色。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(I)某探究小组用HNO3与大理石反应过程中质量减小的方法,研究影响反应速率的因素。所用HNO3浓度为1.00 mol/L、2.00 mol/L,大理石有细颗粒和粗颗粒两种规格,实验温度为25℃、35℃,每次实验HNO3的用量为25.00 mL,大理石用量为10.00 g。
(1)请完成以下实验设计表,并在实验目的一栏中填空:
实验编号 | 温度(℃) | 大理石规格 | HNO3浓度(mol/L) | 实验目的 |
① | 25 | 粗颗粒 | 2.00 | (Ⅰ)实验①和②探究浓度对反应速率的影响; (Ⅱ)实验①和③探究温度对反应速率的影响; (Ⅲ)实验①和④探究e_______对反应速率的影响 |
② | 25 | 粗颗粒 | a______ | |
③ | b_______ | 粗颗粒 | 2.00 | |
④ | c________ | 细颗粒 | d______ |
(2)实验①中CO2质量随时间变化的关系见下图。计算实验①中70 s~90 s范围内用HNO3表示的平均反应速率________(忽略溶液体积变化,不需要写出计算过程)。在0~70、70~90、90~200各相同的时间段里,反应速率最大的时间段是________。
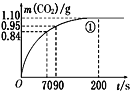
(II)某小组利用H2C2O4溶液和硫酸酸化的KMnO4溶液反应来探究“外界条件对化学反应速率的影响”。实验时通过测定酸性KMnO4溶液褪色所需时间来判断反应的快慢。该小组设计了如下方案。已知:2KMnO4+5H2C2O4+3H2SO4=K2SO4+2MnSO4+10CO2↑+8H2O
实验编号 | 0.1 | 0.6mol·L-1H2C2O4溶液的体积/mL | H2O的体积/mL | 实验温度/℃ | 溶液褪色所需时间/min |
① | 10 | V1 | 35 | 25 | |
② | 10 | 10 | 30 | 25 | |
③ | 10 | 10 | V2 | 50 |
(3)表中V1=_______mL,V2=_______mL。
(4)探究温度对化学反应速率影响的实验编号是________(填编号,下同),可探究反应物浓度对化学反应速率影响的实验编号是________。
(5)实验①测得KMnO4溶液的褪色时间为2min,忽略混合前后溶液体积的微小变化,这段时间内平均反应速率v(H2C2O4)=________mol·L-1·min-1。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】过硫酸钠(Na2S2O8)也叫高硫酸钠、过二硫酸钠,是白色晶状粉末,易溶于水,加热至65℃就会发生分解,用作漂白剂、氧化剂、乳液聚合促进剂。某化学小组对Na2S2O8制备和性质进行探究。
I.实验室制备Na2S2O8
(查阅资料)工业制备过硫酸钠的反应原理:
主反应:(NH4)2S2O8+2NaOH![]() Na2S2O8+2NH3↑+2H2O
Na2S2O8+2NH3↑+2H2O
副反应:2NH3+3Na2S2O8+6NaOH![]() 6Na2SO4+6H2O+N2
6Na2SO4+6H2O+N2
设计如图实验装置:
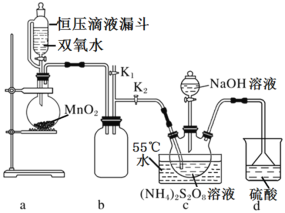
(1)恒压滴液漏斗的优点是___。
(2)装置a中反应产生的气体需要持续通入装置c的目的是___;装置b、d的作用分别是___、___。
(3)反应完毕,将三颈圆底烧瓶中的溶液减压浓缩、结晶过滤、洗涤干燥,可得过硫酸钠,减压浓缩的原因是___。
II.探究Na2S2O8的性质
(1)酸性过硫酸钠溶液,在Ag+催化作用下可以把Mn2+氧化为MnO4-,该方法可用于检验Mn2+,所得溶液除去Ag+后加入BaCl2溶液可以产生白色沉淀。
①用酸性Na2S2O8溶液检验Mn2+时的实验现象为___。
②该反应的离子方程式为____。
(2)过硫酸钠溶液与铜反应只生成两种盐且反应先慢后快,某同学推测反应先慢后快的原因可能是生成的Cu2+对反应起催化作用,设计实验方案检验该推测是否正确___。(供选择试剂:Cu、Na2S2O8溶液、Na2SO4溶液、CuSO4溶液、Cu(NO3)2溶液、CuCl2溶液、蒸馏水)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将物质的量之比为1:1的Fe、Cu的混合粉末逐渐加入到含1mol![]() 的稀硝酸中充分反应(还原产物全部是NO),则能使硝酸完全反应的金属粉末的最小质量为
的稀硝酸中充分反应(还原产物全部是NO),则能使硝酸完全反应的金属粉末的最小质量为
A.14gB.15gC.18gD.22.5g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】己知:25℃时,CaCO3的Ksp=2.8×10-9,现将Na2CO3浓度为2×10-4mol·L-1的Na2CO3溶液与CaCl2溶液等体积混合,若要产生沉淀,则所用CaCl2溶液的浓度至少应大于
A. 2.8×10-2mol·L-1 B. 5.6×10-5mol·L-1
C. 2.8×l0-5 mol·L-1 D. 1.4×l0-5mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用偏铝酸钠(NaA1O2)溶液电解法制备氢氧化铝的简易装置如图所示,其中两电极均为惰性电极。下列说法正确的是( )
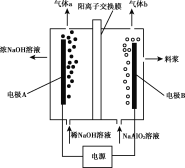
A.电极A为阳极
B.气体b为H2
C.所得料浆液的pH大于原料NaA1O2溶液的pH
D.该方法总反应方程式是:4NaA1O2+10H2O![]() 4A1(OH)3+4NaOH+O2↑+2H2↑
4A1(OH)3+4NaOH+O2↑+2H2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期主族元素W、X、Y、Z的原子序数依次增大,这四种元素仅处于两个周期,其中X元素的最外层电子数是其层数的3倍,这四种元素构成的一种离子化合物的结构如图所示。下列说法正确的是( )
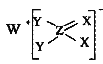
A.原子半径Y>Z>X
B.单质W在其同族元素形成的单质中熔点最低
C.Z的最高价氧化物对应的水化物是中强酸
D.该化合物中的所有元素均满足8电子稳定结构
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com