
| A. | 用BaCl2 溶液可证明Na2CO3溶液显碱性时由于CO32-发生水解 | |
| B. | NaHCO3 溶液中存在:c(Na+ )=c(HCO3-)+c(CO3 2-) | |
| C. | CH3COOH溶液中加入少量CH3COONa 固体后溶液中c(H+)•c(CH3COO-)增大 | |
| D. | 相同温度下,Ksp较小的物质其溶解度也一定较小 |
分析 A.BaCl2与Na2CO3反应生成BaCO3沉淀,结合盐类的水解平衡移动解答;
B.根据物料守恒分析;
C.根据影响Ka=$\frac{c({H}^{+})•c(C{H}_{3}CO{O}^{-})}{c(C{H}_{3}COOH)}$及电离平衡移动的因素分析;
D.化学式组成相似的,Ksp较小的物质其溶解度也一定较小.
解答 解:A.Na2CO3为强碱弱酸盐,水解成碱性,BaCl2与Na2CO3反应生成BaCO3沉淀,水解平衡逆向移动,溶液碱性减弱,需要加酚酞,根据溶液的颜色变化判断,故A错误;
B.NaHCO3 溶液中存在物料守恒:c(Na+ )=c(HCO3-)+c(CO3 2-)+c(H2CO3 ),故B错误;
C.Ka=$\frac{c({H}^{+})•c(C{H}_{3}CO{O}^{-})}{c(C{H}_{3}COOH)}$与浓度无关,CH3COOH溶液中加入少量CH3COONa 固体后,醋酸的电离平衡逆移,醋酸的浓度减小,而Ka不变,所以c(H+)•c(CH3COO-)增大,故C正确;
D.化学式组成相似的,Ksp较小的物质其溶解度也一定较小,化学式结构不同时,不能根据Ksp判断,故D错误.
故选C.
点评 本题考查了盐的水解、弱酸的电离平衡、Ka和Ksp的应用等,题目难度不大,注意把握影响水解、电离平衡的因素.


 备战中考寒假系列答案
备战中考寒假系列答案科目:高中化学 来源: 题型:解答题

 四种有机物,且相对分子质量大小关系为B>C>D.则B、C、D 的结构简式分别是:
四种有机物,且相对分子质量大小关系为B>C>D.则B、C、D 的结构简式分别是: ;CCH3COOH;DHCOOH.
;CCH3COOH;DHCOOH. .
. .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
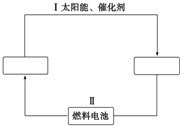 氢能源是21世纪极具开发前景的新能源之一,它既是绿色能源,又可循环使用.请在下图的两个空框中填上循环过程中反应物和生成物的分子式,以完成理想的氢能源循环体系图(循环中接受太阳能的物质在自然界中广泛存在).从能量转换的角度看,过程Ⅱ主要是( )
氢能源是21世纪极具开发前景的新能源之一,它既是绿色能源,又可循环使用.请在下图的两个空框中填上循环过程中反应物和生成物的分子式,以完成理想的氢能源循环体系图(循环中接受太阳能的物质在自然界中广泛存在).从能量转换的角度看,过程Ⅱ主要是( )| A. | 氢能转化为化学能 | B. | 化学能转化为电能 | ||
| C. | 太阳能转化为热能 | D. | 电能转化为化学能 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子半径:A>B>C>D | |
| B. | 离子半径:D(n+1)->Cn->B(n+1)+>An+ | |
| C. | 原子序数:b>a>c>d | |
| D. | 金属性:B>A,气态氢化物稳定性:D>C |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 对该反应体系加热 | B. | 加入少量NaCl溶液 | ||
| C. | 不用锌片,改用锌粉 | D. | 加入少量1 mol•L-1硫酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com