
【题目】MnO2是常见的氧化剂、催化剂和活性电极材料。
(1)工业上,以惰性材料为电极,电解MnSO4溶液(含少量稀硫酸)制备MnO2。写出阳极的电极反应式:___________。
(2)已知如下热化学方程式(K代表平衡常数):
①MnCO3(s)![]() MnO(s)+CO2(g) △H1 K1
MnO(s)+CO2(g) △H1 K1
②2MnO(s)+O2(g)![]() 2MnO2(s) △H2 K2
2MnO2(s) △H2 K2
③2MnCO3(s)+O2(g)![]() 2MnO2(s)+2CO2(g) △H3 K3
2MnO2(s)+2CO2(g) △H3 K3
△H3=______(用△H1、△H2表示) K3=_______(用K1、K2表示)。
(3)反应②在低温条件下能自发进行,则△H2______0(填“>”“<”或“=”)。
(4)在密闭容器中投入足量的MnCO3,—定条件下发生反应:MnCO3(s)![]() MnO(s)+CO2(g)
MnO(s)+CO2(g)
△H>0。在一定温度下,达到平衡状态时p(CO2)=2a MPa。

① 温度、压强对MnCO3分解率的影响如图所示:比较:L1____L2(填“>”“<”或“=”)。
② 保持温度不变,将容器体积扩大至原来的2倍,则p(CO2)的变化范围是______。
③ 保持温度不变,将容器体积压缩至原来的一半,达到新平衡时下列物理量-定不变的是__(填代号)。
A.平衡常数K B.c(CO2) C.n(CO2) D.m(MnCO3)
(5)—定温度下,在容积为2L的恒容密闭容器中加人足量的MnCO3(s)和5molO2,发生反应:2MnCO(s)+O2(g)![]() 2MnO2(s)+2CO2(g),CO2以平均速率0.1mol L-1·min-1经过10min达到平衡状态。该条件下该反应的平衡常数K为_______。
2MnO2(s)+2CO2(g),CO2以平均速率0.1mol L-1·min-1经过10min达到平衡状态。该条件下该反应的平衡常数K为_______。
【答案】(1)Mn2++2H2O-2e-=MnO2+4H+ (2)2△H1+△H2 ![]() ·K2
·K2
(3)< (4①) > ② a MPa<p(CO2)<2a MPa ③ AB (5) 0.5mol.L-1
【解析】(1)根据电解原理,用惰性电极电解MnSO4溶液制得MnO2的阳极为:Mn2+失电子发生氧化反应生成MnO2,其阳极电极反应式是Mn2++2H2O2e-=MnO2+4H+。
(2)由已知三个化学方程式可得:③=①×2+②,所以△H1=2△H1+△H2 、K3= K12K2 。
(3)反应②在低温条件下能自发进行,所以△H2T△S<0,根据化学方程式可看出△S<0,所以△H2<0。
(4)①根据上述MnCO3分解的化学方程式及△H>0可得:增大压强压缩体积,MnCO3分解率降低,升高温度MnCO3分解率增大,所以图中X代表压强,L1和L2代表温度,L1>L2;②保持温度不变,将容器体积扩大至原来的2倍,若平衡不移动,则p(CO2)= a MPa,而实际情况是:降低压强平衡右移,所以p(CO2)> MPa,又根据化学平衡移动原理(即勒夏特列原理)p(CO2)< 2a MPa,综上所述,a MPa <p(CO2)< 2a MPa;③ 保持温度不变,化学平衡常数不变,将容器体积压缩至原来的一半,化学平衡逆向移动,n(CO2)减小, m(MnCO3)增大,因为只有一种气体,所以c(CO2)不变。故选AB。
(5)由题意该反应达到平衡状态时c(CO2)=0.1mol L-1 min-1×10min=1 mol L-1,列三段式得:

所以K=![]() =(1 mol·L-1)2 ÷ 2 mol·L-1=0.5mol.L-1。
=(1 mol·L-1)2 ÷ 2 mol·L-1=0.5mol.L-1。


 春雨教育同步作文系列答案
春雨教育同步作文系列答案科目:高中化学 来源: 题型:
【题目】将 4 mol A 气体和 2 mol B 气体在 2 L 的密闭容器中混合并在一定条件下发生如下反应2A(g)+B(g)![]() 2C(g);△H <0。4 s(秒)后反应达到平衡状态,此时测得 C 的浓度为0.6 mol·L-1。下列说法中正确的是
2C(g);△H <0。4 s(秒)后反应达到平衡状态,此时测得 C 的浓度为0.6 mol·L-1。下列说法中正确的是
A. 当A、B、C物质的量浓度之比为2:1:2时,反应即达到平衡状态
B. 4s内用物质B表示的反应速率为0.075mol·L-1·s-1
C. 达平衡后若通入一定量氦气,A的转化率降低
D. 达平衡后若升高温度,C的浓度将增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质久置于空气中会发生相应的变化,其中发生了氧化还原反应的是( )
A.浓硫酸的体积增大
B.铝的表面生成致密的薄膜
C.澄清的石灰水变浑浊
D.氢氧化钠的表面发生潮解
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列哪些操作,不适宜保存蔬菜中的维生素 ( )
A. 洗菜:要先洗后切
B. 浸泡:切好的菜要浸泡半天,以除去残留农药
C. 切菜:要随切随炒,切忌切好后久置
D. 烹饪:烹调蔬菜时适当加点醋,可以减少维生素C的损失
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(2016天津)氢能是发展中的新能源,它的利用包括氢的制备、储存和应用三个环节。回答下列问题:
(1)与汽油相比,氢气作为燃料的优点是_________(至少答出两点)。但是氢气直接燃烧的能量转换率远低于燃料电池,写出碱性氢氧燃料电池的负极反应式:____________。
(2)氢气可用于制备H2O2。已知:
H2(g)+A(l)=B(l) ΔH1
O2(g)+B(l)=A(l)+H2O2(l) ΔH2
其中A、B为有机物,两反应均为自发反应,则H2(g)+ O2(g)= H2O2(l)的ΔH____0(填“>”、“<”或“=”)。
(3)在恒温恒容的密闭容器中,某储氢反应:MHx(s)+yH2(g)![]() MHx+2y(s) ΔH<0达到化学平衡。下列有关叙述正确的是________。
MHx+2y(s) ΔH<0达到化学平衡。下列有关叙述正确的是________。
a.容器内气体压强保持不变
b.吸收y mol H2只需1 mol MHx
c.若降温,该反应的平衡常数增大
d.若向容器内通入少量氢气,则v(放氢)>v(吸氢)
(4)利用太阳能直接分解水制氢,是最具吸引力的制氢途径,其能量转化形式为_______。
(5)化工生产的副产氢也是氢气的来源。电解法制取有广泛用途的Na2FeO4,同时获得氢气:Fe+2H2O+2OH![]() FeO42+3H2↑,工作原理如图1所示。装置通电后,铁电极附近生成紫红色的FeO42,镍电极有气泡产生。若氢氧化钠溶液浓度过高,铁电极区会产生红褐色物质。已知:Na2FeO4只在强碱性条件下稳定,易被H2还原。
FeO42+3H2↑,工作原理如图1所示。装置通电后,铁电极附近生成紫红色的FeO42,镍电极有气泡产生。若氢氧化钠溶液浓度过高,铁电极区会产生红褐色物质。已知:Na2FeO4只在强碱性条件下稳定,易被H2还原。

①电解一段时间后,c(OH)降低的区域在_______(填“阴极室”或“阳极室”)。
②电解过程中,须将阴极产生的气体及时排出,其原因是_______。
③c( Na2FeO4)随初始c(NaOH)的变化如图2,任选M、N两点中的一点,分析c(Na2FeO4)低于最高值的原因:_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】雾霾天气是一种大气污染状态,雾霾的源头多种多样,比如汽车尾气、工业排放、建筑扬尘、垃圾焚烧,甚至火山喷发等。
(1)汽车尾气中的NO(g)和CO(g)在一定温度和催化剂的条件下可净化。
①已知部分化学键的键能如下
分子式/结构式 | NO/N≡O | CO/C≡O | CO2/O=C=O | N2/N≡N |
化学键 | N≡O | C≡O | C=O | N≡N |
键能(KJ/mol) | 632 | 1072 | 750 | 946 |
请完成汽车尾气净化中NO(g)和CO(g)发生反应的热化学方程式
2NO(g)+2CO(g)![]() N2(g)+2CO2(g) ΔH=_________kJ/mol
N2(g)+2CO2(g) ΔH=_________kJ/mol
②若上述反应在恒温、恒容的密闭体系中进行,并在t1时刻达到平衡状态,则下列示意图不符合题意的是_________(填选项序号)。(下图中v正、K、n、P总分别表示正反应速率、平衡常数、物质的量和总压强)
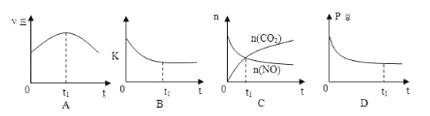
(2)在t1℃下,向体积为10L的恒容密闭容器中通入NO和CO , 测得了不同时间时NO和CO的物质的量如下表:
时间/s | 0 | 1 | 2 | 3 | 4 | 5 |
n(NO)/×l0-2mol | 10.0 | 4.50 | 2.50 | 1.50 | 1.00 | 1.00 |
n(CO)/×l0-1mol | 3.60 | 3.05 | 2.85 | 2.75 | 2.70 | 2.70 |
t1℃时该反应的平衡常数K=__,既能增大反应速率又能使平衡正向移动的措施是_。(写出一种即可)
(3)如图1所示,以N2O4为原料采用电解法可制备新型绿色硝化剂(一种氮氧化物)写出生成这种硝化剂的阳极电极反应式________________________。
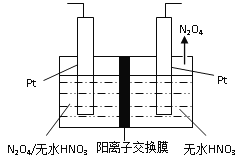
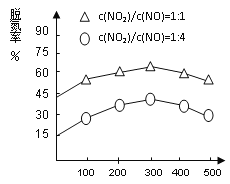
图1 图2
(4)NH3催化还原氮氧化物(SCR)技术是目前应用最广泛的烟气氮氧化物脱除技术。在氨气足量的情况下,不同c(NO2)/c(NO)、不同温度对脱氮率的影响如图2所示(已知氨气催化还原氮氧化物的正反应为放热反应),请回答温度对脱氮率的影响_______________,给出合理的解释:____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】合成氨工业对国民经济和社会发展具有重要的意义。对于密闭容器中的反应:N2(g)+3H2(g) ![]() 2NH3(g),ΔH<0,673K,30MPa下n(NH3)和n(H2)随时间变化的关系如下图所示。下列叙述正确的是( )
2NH3(g),ΔH<0,673K,30MPa下n(NH3)和n(H2)随时间变化的关系如下图所示。下列叙述正确的是( )
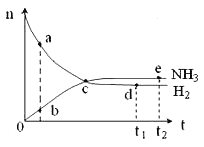
A. 点a的n(H2)和点b的n(NH3)比值为3∶2
B. 点 c处反应达到平衡
C. 点d (t1时刻)和点 e (t2时刻) 处n(N2)不一样
D. 其他条件不变,773K下反应至t1时刻,n(H2)比右图中d点的值大
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com