
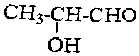 的所有同分异构体中属于酯类的同分异构体共有几种( )
的所有同分异构体中属于酯类的同分异构体共有几种( )| A. | 1种 | B. | 2种 | C. | 3种 | D. | 4种 |
 培优口算题卡系列答案
培优口算题卡系列答案 开心口算题卡系列答案
开心口算题卡系列答案 口算题卡河北少年儿童出版社系列答案
口算题卡河北少年儿童出版社系列答案 A加金题 系列答案
A加金题 系列答案科目:高中化学 来源: 题型:解答题
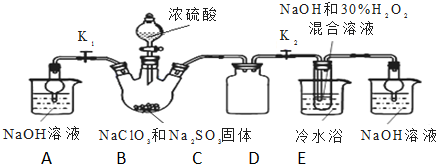
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
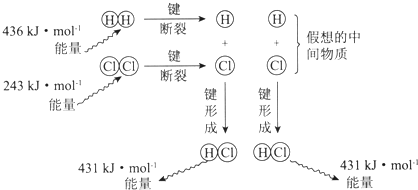
| A. | 该反应的反应热△H=-183kJ•mol-1 | |
| B. | 该反应生成液态HCl比生成气态HCl释放的能量少 | |
| C. | 氯气分子中的化学键比氢气分子中的化学键更稳定 | |
| D. | 1 mol HCl分子中的化学键形成时吸收431kJ的能量 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 容器 编号 | c(H2O)/mol•L-1 | c(CO)/mol•L-1 | c(H2)/mol•L-1 | ν正、ν逆比较 |
| I | 0.06 | 0.60 | 0.10 | ν正=ν逆 |
| Ⅱ | 0.12 | 0.20 | 0.60 | ν正=ν逆 |
| Ⅲ | 0.10 | 0.20 | 0.40 | ν正>ν逆 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 实际应称Na2CO3质量/g | 应选用容量瓶的规格/mL |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
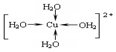 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | BaCl2溶液和K2SO4溶液反应 | B. | Al放入烧碱溶液中 | ||
| C. | NaOH溶液和CuSO4溶液反应 | D. | KSCN溶液和FeCl3溶液反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 两溶液的导电能力和pH值均相同 | |
| B. | 中和两溶液,消耗NaOH的物质的量相同 | |
| C. | 分别与足量的Zn完全反应,盐酸产生的速率快,氢气多 | |
| D. | 当把两种酸各10mL混合后,加10mL 0.1mol•L-1的NaOH,则有c(H+)=c(CH3COO-) |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com