
| A、CH4既被氧化又被还原 |
| B、H2O既不是氧化剂又不是还原剂 |
| C、在反应条件下,每消耗1mol H2O必然生成67.2L H2 |
| D、建立平衡后,使用更高效的催化剂,可使H2的产率提高 |


 名师指导期末冲刺卷系列答案
名师指导期末冲刺卷系列答案 开心蛙口算题卡系列答案
开心蛙口算题卡系列答案科目:高中化学 来源: 题型:
| A、氢氟酸贮存在细口玻璃瓶里 |
| B、盛溴的试剂瓶里加一些水来防止溴挥发 |
| C、盛放浓硫酸的广口瓶应当用磨口玻璃塞,不能用橡皮塞 |
| D、氯水保存在无色玻璃瓶中;液氯存贮存在钢瓶里 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、SO2、H2S、Cl2 |
| B、SO2、O2、NH3 |
| C、SO2、CO2、O2 |
| D、HCl、H2S、HI |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、该装置可能是原电池,可用Cu、C作电极,电解质溶液是盐酸 |
| B、该装置可能是原电池,电解质溶液为硝酸 |
| C、该装置只能是电解池,金属铜为该电解池的阳极,K2SO4为电解质溶液 |
| D、该装置只能是电解池,金属铜为该电解池的阳极,稀H2SO4为电解质溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、人体缺碘会引起大脖子病,缺铁会引起贫血 |
| B、硅是构成一些岩石和矿物的基本元素 |
| C、NaHCO3受热易分解放出CO2,常用于制作糕点 |
| D、将Na2SO4分入钠盐和硫酸盐的分类方法属于树状分类法 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、强酸性溶液中:K+、S2-、ClO-、SO42- |
| B、含有0.1mol?L-1 Fe3+的溶液中:K+、Mg2+、I-、NO3- |
| C、室温下,pH=1的溶液中:Na+、Fe3+、NO3-、SO42- |
| D、加入Al能放出H2的溶液中::Na+、K+、CO32-、Cu2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:
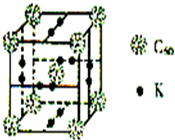 碳、氢、氟、氮、硅等非金属元素与人类的生产生活息息相关.回答下列问题:
碳、氢、氟、氮、硅等非金属元素与人类的生产生活息息相关.回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:
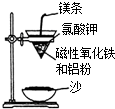 某校高三同学高考前重做以下两个课本实验,请你回答实验过程中的相关问题:
某校高三同学高考前重做以下两个课本实验,请你回答实验过程中的相关问题:| 编号 | 温度/℃ | H2SO4体积/mL | KI溶液体积/mL | H2O体积/mL | 淀粉溶液 /mL | 出现蓝色时间/s |
| A | 39 | 10 | 5 | 5 | 1 | 5 |
| B | TB | 10 | 5 | 5 | 1 | 没出现蓝色 |
| C | 5 | 10 | 5 | 5 | 1 | 39 |
| D | t |
查看答案和解析>>
科目:高中化学 来源: 题型:
 如图所示的装置,在盛有水的烧杯中,等质量的铁圈和银圈的连接在一起,吊着一根绝缘的细丝,使之平衡.小心地从烧杯中央滴入CuSO4溶液.试回答下列问题:(相对原子质量:Fe-56,Cu-64)
如图所示的装置,在盛有水的烧杯中,等质量的铁圈和银圈的连接在一起,吊着一根绝缘的细丝,使之平衡.小心地从烧杯中央滴入CuSO4溶液.试回答下列问题:(相对原子质量:Fe-56,Cu-64)查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com