
实验室可用K2Cr2O7固体与浓盐酸混合加热制备氯气(K2Cr2O7被还原为Cr3+)。
(1)K2Cr2O7与浓盐酸反应的化学方程式为_______;若反应中转移3 mol e-,则消耗_______mol K2Cr2O7
(2)稀盐酸与K2Cr2O7固体混合加热没有氯气生成。为探究影响氯气生成的因素,某化学兴趣小组进行如下实验:
①提出假设
假设1:Cl-浓度对反应有影响;
假设2:H+浓度对反应有影响;
假设3: _____________________。
②设计实验方案,进行实验。写出实验步骤及预期现象和结论。
限选举实验试剂:浓盐酸、稀盐酸、浓硫酸、NaOH溶液、K2Cr2O7固体、NaCl固体、湿润的淀粉KI试纸
| 实验步骤 | 预期现象和结论 |
| 步:1:向盛有K2Cr2O7固体的A、B两试管中分别加入一定量的稀盐酸。 | |
| 步骤2: | |
| 步骤3: | |
(1)K2Cr2O7+14HCl(浓) 2KCl+2CrCl3+3Cl2↑+7H2O 0.5
2KCl+2CrCl3+3Cl2↑+7H2O 0.5
(2)①Cl-浓度、H+ 浓度对反应都有影响
②步骤2:向A试管中加入适量NaCl固体,加热,把湿润的淀粉KI试纸放在试管口附近 ㈠若试纸变蓝,则假设1成立;
㈡若试纸未变蓝,则假设2或3成立步骤3:向B试管中加入适量浓硫酸,加热,把湿润的淀粉KI试纸放在试管口附近 ㈠若试纸变蓝,则假设2成立
㈡若试纸未变蓝,结合步骤2中的㈡,则假设3成立
(其它合理答案也可给分)
解析试题分析:(1)根据题意,Cr被还原为Cr3+,Cl-被氧化为Cl2,然后依据氧化还原反应电子得失守恒和原子守恒可写出方程式。依据方程式,消耗1mol K2Cr2O7转移电子6mol,转移3mol电子时消耗0.5mol K2Cr2O7。
(2)①根据假设1和假设2,假设3应为假设1、2的综合。
②依据假设,可知步骤一为对照实验标准,步骤二、三应分别改变氯离子浓度、氢离子浓度,改变氯离子浓度可通过加入NaCl实现,改变氢离子浓度可通过加入浓硫酸实现。然后用湿润的淀粉KI实质检验是否产生Cl2。
考点:考查氧化还原反应方程式书写及计算,化学实验原理,实验设计,化学实验操作等。


科目:高中化学 来源: 题型:填空题
实验室欲配制100 mL、1mol/L的NaCl溶液,请回答:
(1)不需要使用的仪器是 。
A、烧杯B、500 mL容量瓶C、量筒 D、胶头滴管 E、玻璃棒 F、100 mL容量瓶
(2)配制时用托盘天平应称取NaCl g。
(3)配制溶液的操作顺序是(用字母表示) 。
A、称量 B、洗涤 C、定容 D、溶解 E、摇匀 F、转移
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
作为高中生,学会利用我们课堂上学到的知识来解决生活中的一些问题,是我们学习的重要目的之一。重庆一中某化学实验兴趣小组,一行四人,利用实验室老师提供的基本仪器和药品,自行购置了鸡蛋,食醋等生活用品,进行了如下探究。
I. 甲同学老家在山西,对儿时在家乡品尝到的山西老陈醋的滋味记忆犹新,跟随父母来到重庆后,总是觉得超市买到的醋不如儿时的味道,查阅相关资料后,得知以下信息:
①醋分两种,酿造醋和配制醋。正宗的老陈醋必须经长久时间酿造才得此美味,市场上多充斥着工业醋酸加水勾兑的配制醋。
②酿造醋国家标准为醋酸含量必须大于3.50 g/100mL,而配制醋国家标准仅为1.50 g~3.50g/100mL。
③在老师的帮助下,测定了超市购买的食醋中,醋酸的物质的量浓度为0.75mol/L。
(1)请帮助张同学计算从超市购买的食醋中醋酸含量为_______g/100mL,属于____________醋(填“酿造”或“配制”)。(提示:醋酸摩尔质量为60g/mol)
(2)请写出醋酸与鸡蛋壳(主要成分为CaCO3)反应的离子方程式_______________________________。
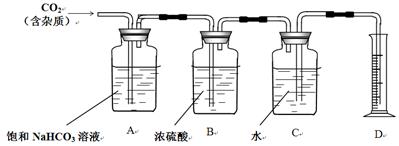
II. 下图是重庆一中化学实验室浓盐酸试剂标签上的部分内容。乙同学现用该浓盐酸配100mL1mol/L的稀盐酸。可供选用的仪器有:①胶头滴管;②烧瓶;③烧杯;④药匙;⑤量筒;⑥托盘天平;⑦玻璃棒。请回答下列问题:
(1)配制稀盐酸时,还缺少的仪器有 ;
(2)经计算,配制100mL1mol/L的稀盐酸需要用量筒量取上述浓盐酸的体积为 mL(保留小数点后一位);
(3)对所配制的稀盐酸进行测定,发现其浓度小于1mol/L,引起误差的原因可能是 。
| A.定容时俯视容量瓶刻度线 |
| B.容量瓶在使用前未干燥,里面有少量蒸馏水 |
| C.转移溶液后,未洗涤烧杯和玻璃棒 |
| D.定容摇匀后发现液面低于容量瓶的刻度线,再加水至刻度线 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
亚氯酸钠(NaClO2)是一种重要的含氯消毒剂,在碱性溶液中NaClO2比较稳定,主要用于水的消毒以及砂糖、油脂的漂白与杀菌。以下是过氧化氢法生产亚氯酸钠的工艺流程图: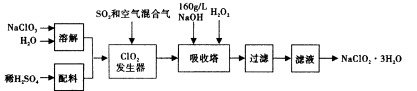
已知:①NaClO2的溶解度随温度升高而增大,适当条件下可结晶析出NaClO2·3H2O。
②纯ClO2易分解爆炸,一般用稀有气体或空气稀释到10%以下安全。
③160 g/L NaOH溶液是指160 g NaOH固体溶于水所得溶液的体积为1L。
(1)160 g/L NaOH溶液的物质的量浓度为____。若要计算该溶液的质量分数,还需要的一个条件是____(用文字说明)。
(2)发生器中鼓入空气的作用可能是____(选填序号)。
a.将SO2氧化成SO3,增强酸性;
b.稀释ClO2以防止爆炸;
c.将NaClO3氧化成ClO2
(3)吸收塔内的反应的化学方程式为____。吸收塔的温度不能超过20℃,其目的是 。
(4)吸收塔中应维持NaOH稍过量,理由是____。
(5)吸收塔中能否用FeCl2代替H2O2____(填能.否)?理由是____。
(6)从滤液中得到NaClO2·3H2O粗晶体的实验操作依次是____(选填序号)。
A.蒸馏 b.蒸发 c.灼烧 d.过滤 e.冷却结晶
要得到更纯的NaClO2·3H2O晶体必须进行的操作是____(填操作名称)。
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
(10分)某实验小组用0.50 mol·L-1 NaOH溶液和0.50 mol·L-1硫酸溶液进行中和热的测定。
Ⅰ.配制0.50 mol·L-1 NaOH溶液
(1)若实验中大约要使用245 mL NaOH溶液,至少需要称量NaOH固体________g。
(2)从下图中选择称量NaOH固体所需要的仪器(填字母):__________。
| 名称 | 托盘天平(带砝码) | 小烧杯 | 坩埚钳 | 玻璃棒 | 药匙 | 量筒 |
| 仪器 | 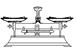 | 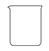 |  |  |  |  |
| 序号 | a | b | c | d | e | f |
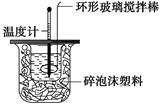
 温度 温度实验次数 | 起始温度t1/℃ | 终止温度t2/℃ | 温度差平均值 (t2-t1)/℃ | ||
| H2SO4 | NaOH | 平均值 | |||
| 1 | 26.2 | 26.0 | 26.1 | 30.1 | |
| 2 | 27.0 | 27.4 | 27.2 | 31.2 | |
| 3 | 25.9 | 25.9 | 25.9 | 29.8 | |
| 4 | 26.4 | 26.2 | 26.3 | 30.4 | |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
(12分)硫代硫酸钠(Na2S2O3·5H2O)俗名“大苏打”,又称为“海波”。它易溶于水,难溶于乙醇,加热易分解。工业上常用亚硫酸钠法、硫化碱法等制备。某实验室模拟工业硫化碱法制取硫代硫酸钠,其反应装置及所需试剂如下图:实验具体操作步骤为:
①开启分液漏斗,使硫酸慢慢滴下,适当调节螺旋夹,使反应产生的SO2气体较均匀地通入Na2S和Na2CO3的混合溶液中,同时开启电磁搅拌器搅动。
②至析出的硫不再消失,控制溶液的pH接近
7时,停止通入SO2气体。
③抽滤所得的滤液,转移至蒸发皿中,水浴加热
浓缩,直到溶液表面出现晶膜。
④冷却结晶、抽滤、洗涤。
⑤将晶体放入烘箱中,在40~45℃左右干燥
50~60min,称量。
请回答以下问题:
(l)仪器a的名称是 ;
(2)步骤②中若控制pH值小于7,则产率会下降,请用离子方程式解释原因: 。
(3)步骤③中不能将溶液蒸发至干的原因是 ;晶膜通常在溶液表面出现的原因是 。
(4)步骤④中洗涤硫代硫酸钠晶体所用试剂的结构式是 。
(5)为检验制得的产品的纯度,该实验小组称取5,0克的产品配制成250mL硫代硫酸钠溶液,并用间接碘量法标定该溶液的浓度:在锥形瓶中加入25mL 0.0lmol·L-1 KIO3溶液,并加入过量的KI并酸化,发生下列反应:5I-+IO3-+6H+=3I2+3H2O,再加入几滴淀粉溶液,立即用所配Na2S2O3溶液滴定,发生反应:I2+2S2O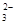 =2I-+S4O
=2I-+S4O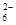 ,当蓝色褪去H半分钟不变色时到达滴定终点。实验数据如下表:
,当蓝色褪去H半分钟不变色时到达滴定终点。实验数据如下表:
| 实验序号 | 1 | 2 | 3 |
| Na2S2O3溶液体积(mL) | 19.98 | 20.02 | 21.18 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
实验室中有一未知浓度的稀盐酸,某学生测定盐酸的浓度在实验室中进行实验。请完成填空:
(1)配制100 mL 0.10 mol/L NaOH标准溶液。
①主要操作步骤:计算→称量→溶解→(冷却后)转移→洗涤(并将洗涤液移入容量瓶)→ →将配制好的溶液倒入试剂瓶中,贴上标签。
②称量 g氢氧化钠固体所需仪器有:天平(带砝码、镊子)、 、 。
(2)取20.00 mL待测盐酸溶液放入锥形瓶中,并滴加2~3滴酚酞作指示剂,用自己配制的标准液NaOH溶液进行滴定。重复上述滴定操作2~3次,记录数据如下:
| 实验编号 | NaOH溶液的浓度(mol/L) | 滴定完成时, NaOH溶液滴入的体积(mL) | 待测盐酸溶液的体积(mL) |
| 1 | 0.10 | 22.62 | 20.00 |
| 2 | 0.10 | 22.72 | 20.00 |
| 3 | 0.10 | 22.80 | 20.00 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
掌握仪器的名称、组装及使用方法是中学化学实验的基础,下图为两套实验装置。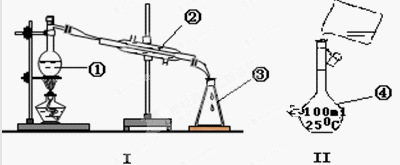
⑴写出下列仪器的名称:
①____________;②_____________;④__________;
⑵仪器①~④中,使用时必须检查是否漏水的有______。(填序号)
⑶若利用装置I分离四氯化碳和乙醇的混合物,还缺少的仪器是_________,将仪器补充完整后进行的实验操作的名称为_____________ 。现需配制250 mL 0.2 mol/L NaCl溶液,装置II是某同学转移溶液的示意图,图中的错误是______________、_________________ 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com