
| A. | BaSO4?Ba2++SO42- | B. | HF═H++F- | ||
| C. | HI?H++I- | D. | NaHCO3═Na++HCO3- |
分析 A.硫酸钡为强电解质,完全电离,用等号;
B.氢氟酸为弱酸,部分电离,应用可逆号;
C.碘化氢为强电解质,完全电离,用等号;
D.碳酸氢钠为强电解质,完全电离,用等号;
解答 解:A.硫酸钡为强电解质,完全电离,电离方程式:BaSO4=Ba2++SO42-,故A错误;
B.氢氟酸为弱酸,部分电离,电离方程式:HF?H++F-,故B错误;
C.碘化氢为强电解质,完全电离,电离方程式:HI=H++I-,故C错误;
D.碳酸氢钠为强电解质,完全电离,电离方程式:NaHCO3═Na++HCO3-,故D正确;
故选:D.
点评 本题考查了电解质电离方程式的书写,明确电解质强弱及电离方式是解题关键,注意强电解质用等号,弱电解质用可逆号.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:解答题
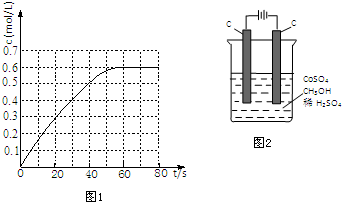
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 工业上常通过电解熔融的MgO冶炼金属镁 | |
| B. | 应用盖斯定律,可计算某些难以直接测量的反应焓变 | |
| C. | 用惰性电极电解Na2SO4溶液,阴、阳两极产物的物质的量之比为1:2 | |
| D. | 在铁上镀铜,应选用铜作阴极 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | M、N全部变成了Q | |
| B. | M、N、Q三种物质的浓度一定相等 | |
| C. | 反应已经停止 | |
| D. | 反应混合物各成分的百分组成不再变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
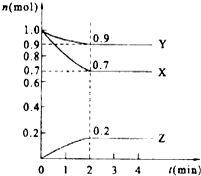 某温度时,在2L的密闭容器中,X、Y、Z三种物质的量随时间的变化曲线如图所示.
某温度时,在2L的密闭容器中,X、Y、Z三种物质的量随时间的变化曲线如图所示.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Al3+、Na+、NO3-、Cl- | B. | K+、Na+、Cl-、CO32- | ||
| C. | NH4+、Na+、Cl-、SO42- | D. | NH4+、K+、SiO32-、NO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 不慎将酸溅到眼中,应立即用水洗,边洗边眨眼睛 | |
| B. | 不慎将少量浓硫酸沾到皮肤上,应立即用大量水洗,然后涂上硼酸溶液 | |
| C. | 如果汽油、煤油等可燃物着火,应立即用水扑灭 | |
| D. | 酒精灯不慎碰翻着火,应立即用湿布扑灭 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氮气化学性质不活泼,可用作食品防腐剂 | |
| B. | 硅胶无毒、无味、无腐蚀性,可用作食品干燥剂 | |
| C. | SiO2、Al2O3、MgO都有很高的熔点,可以制耐火材料 | |
| D. | 二氧化锰具有强氧化性,可用作H2O2分解的氧化剂 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com