
����Ŀ���ҹ���ѧ�Һ�°�ĸ����Ĵ����������գ��������̿ɼ�Ҫ��ʾΪ��ͼ��ʾ
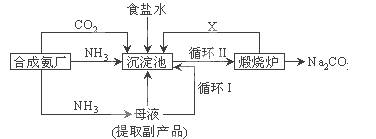
��1�������Ƽ�ֳ�___________������Ʒ��һ����;Ϊ____________ .
��2��д������������ X ���ʵķ���ʽ________��
��3��Ϊ�����Ʒ̼�������Ƿ����Ȼ��ƣ���ȡ������������ˮ�У��ٵμ�_________��
��4�������������ά����ȣ������Ƽ���ŵ㣺____��
��5����ͼ����ʵ������ģ�⡰�������ȡ NaHCO3 �IJ���װ�á�
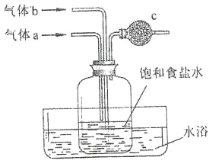
���������գ�
��ϸ�۲���ֻͨ��������������λ�ã��ɴ��ƶϣ�
���� a Ϊ_____������ b Ϊ_________�����ߵ�ͨ�����Ϊ_____�� Ϊ��ֹβ����Ⱦ��c �пɷ���պ_____��Һ����֬�ޡ�
��6������ a �� b ��������ͼװ�ý����Ʊ��� ����ƿ�й���Ϊ��ʯ��ʱ����Һ©����Ӧʢ��_________�� �ø�װ���Ʊ���һ������ķ����ǣ�_____�������ӷ���ʽ��ʾ����
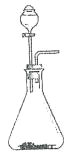
��7����Ӧ�����п��Կ���װ�ñ���ʳ��ˮ���о�����������д����ط�Ӧ�Ļ�ѧ����ʽ��________��
��8����Ӧ�����в���ˮԡ���ȣ���������_____��
ˮԡ�¶�ά���� 42�����ң��¶ȹ��ͣ���Ӧ����̫���������ھ����������¶ȹ��ߣ�_____��Ҳ�����ھ���������
��9����Ӧ��������ˮԡ���ɱ�ˮԡ����ȴ 15min �����ٽ��й��ˣ�Ŀ���ǣ�_________��
��10���õ��� NaHCO3 �����лẬ������ NaCl ���ʣ��ɲ������·������д��Ȳⶨ��
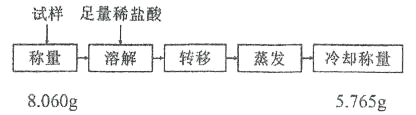
�������� NaHCO3 ����������Ϊ_____����ȷ�� 0.01���������������������ղⶨ�����������Ϊ 1.5%��д�����ܵ��¸ý����һ�������___________��
���𰸡������Ƽ������CO2�����ữ����������Һ���۲������ɫ����ʹ NH4Cl �������������ʣ��������õ� CaCl2 ���ɣ�ԭ�� NaCl ������ð���������̼��ͨ a ��ͨ b����Ũ��ˮCaCO3+2H+=Ca2++CO2��+H2ONaCl+NH3+CO2+H2O=NaHCO3��+NH4Cl����ƽ�ȣ����ڿ����¶� �����ܽ�ȸ�����̼�����Ƶ������ʣ���߲���0.94����ˮ��δ��ȫ���ɵ�
��������
(1)Ŀǰ��ҵ�Ƽ���ж�������������Ƽ�����з��������Ǻ�°���������Ϊ�����Ƽ,Ҳ��Ϊ�����Ƽ,��Ӧ����ʽΪNH3+H2O+CO2+NaCl=NH4Cl+NaHCO3�����õ�̼������ͬʱ�õ��Ȼ�����ʸ�����Ϊ�Ȼ�����Ȼ�刺�����������������ˣ�������ȷ����:�����Ƽ����������
(2) �������Ƽ�ж�����̼�Ƿ�Ӧ��ԭ��ͬʱҲ�Ƿ�Ӧ�ĸ�����,����ѭ����������ˣ�������ȷ����: CO2 ��
(3)�����Ʒ̼�������Ƿ����Ȼ��Ƽ������Ƿ��������������������ữ�����������۲쵽��������ɫ��������˵�����Ȼ��ƴ�������ˣ�������ȷ����: �����ữ����������Һ���۲������ɫ������
��4������ά���Ƽȱ�㣺����CaCl2��;����NaCl������ֻ��70%��Լ��30%��NaCl����ĸҺ���������Ƽ���ŵ㣺ԭ�������ʸߣ��������ܹ������ʣ������������ʵ����ɣ���ȷ�𰸣�ʹ NH4Cl �������������ʣ��������õ� CaCl2 ���ɣ�ԭ�� NaCl ������á�
��5��������������ˮ��������̼����ˮ���ܽ����Խ�С��Ϊ�����ڶ�����̼���ܽ⣬��ͨ������̼�ĵ���������Һ��֮�£�����ͨ�백�����γɼ�����Һ�����ն�����̼�����������ŷſ����У���ϡ�������գ���ȷ�𰸣�������������̼����ͨa��ͨb��ϡ���ᡣ
��6��ͼ2װ��Ϊ��Һ���������Ʊ���������ѡ����Ũ��ˮ�м�����ʯ����ȡ����������ƿ�й���Ϊ��ʯ��ʱ����Һ©����Ӧʢ��Ũ��ˮ�� ���������ʯ�м���ϡ�����Ʊ�������̼���������ӷ���ʽ��CaCO3+2H+=Ca2++CO2��+H2O;��ȷ�𰸣�Ũ��ˮ ��CaCO3+2H+=Ca2++CO2��+H2O��
��7������ʳ��ˮ��ͨ�백���Ͷ�����̼����̼�����ƾ��壬��ѧ����ʽΪ��NaCl+NH3+CO2+H2O=NaHCO3��+NH4Cl����ȷ�𰸣�NaCl+NH3+CO2+H2O=NaHCO3��+NH4Cl��
��8��ˮԡ���������ڼ���ƽ�ȣ����ڿ����¶ȣ�ˮԡ�¶�ά����42�����ң��¶ȹ��ͣ���Ӧ����̫���������ھ����������¶ȹ��ߣ�������ܽ�ȴ����ھ�����������ȷ�𰸣�����ƽ�ȣ����ڿ����¶ȣ� �����ܽ�ȸߡ�
��9��̼�����Ƶ��ܽ�����¶ȵĽ��Ͷ����ͣ���Ӧ��������ˮԡ���ɱ�ˮԡ����ȴ15min�����ٽ��й��ˣ�Ŀ��������̼�����Ƶ������ʣ���߲��ʣ���ȷ�𰸣�����̼�����Ƶ������ʣ���߲��ʡ�
��10������Ʒ��NaHCO3��NaCl�����ʵ����ֱ�Ϊxmol��ymol����84x+58.5y=8.060���������ᣬNaHCO3�����ᷴӦ�õ��Ȼ��ƣ����������ᾧ�õ��Ȼ��ƹ�������5.765g,������Ӧ������ѭ��ԭ�ӵ����غ㣺x+y=5.765/58.5���������������̣��õ���x=0.09mol,y=0.009mol,���Ը������� NaHCO3 ����������Ϊ0.09��84/8.060��100%=94%=0.94�������������������ղⶨ�����������Ϊ 1.5%��˵����ʵ�����ƫ������ܲ���ˮ��δ��ȫ������ȷ�𰸣�0.94������ˮ��δ��ȫ����



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���߷��Ӳ���PET������֬��PMMA�ĺϳ�·�����£�

��֪��  ��R��R�����������
��R��R�����������
��1���ٵķ�Ӧ������____________________��
��2���ڵĻ�ѧ����ʽΪ________________________________________��
��3��F�ĺ˴Ź���������ʾֻ��һ��壬�ݵĻ�ѧ����ʽΪ____________��
��4��G�Ľṹ��ʽΪ____________________��
��5���ߵĻ�ѧ����ʽΪ______________________________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ش��������⣺
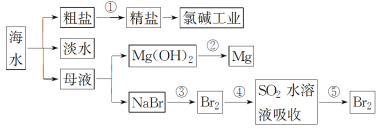
��1�����̢���Ϊ�˳�ȥ�����е�SO42����Ca2����Mg2����Fe3�������ʣ���Ҫ��ȥSO42��������Ҫ������Լ�Ϊ_____________�������ӵĸ��Լ�����������Ա�������________________��ȥ��
��2�����̢��ܷ�һ��ʵ��ת����______________����ܡ�����Mg(OH)2�����ᷴӦ���Եõ�MgCl2��Һ����÷�Ӧ�����ӷ���ʽΪ_____________________________________________��
��3�����̢ܷ�Ӧ�����ӷ���ʽΪ_____________________________________________________��
��4������CCl4��ȡ��ˮ�е�Br2����ҺʱCCl4��Ӧ�ӷ�Һ©����_____________�ų���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij��������Ԫ��X����̬�⻯��Ļ�ѧʽΪXH3����X������������ˮ����Ļ�ѧʽΪ(�� ��)
A. H2XO3 B. HXO3 C. H3XO4 D. H2XO4
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������β��������̼��Ҫԭ��Ϊ2NO(g)+2CO(g)![]() N2(g)+2CO2(g) +Q��Q>0����һ���������ܱ�����
N2(g)+2CO2(g) +Q��Q>0����һ���������ܱ�����
�У��ô�������ø÷�Ӧ�ڲ�ͬʱ�� NO �� CO Ũ�����±���
ʱ��/s | 0 | 1 | 2 | 3 | 4 |
c(NO)/molL-1 | 9.50��10-3 | 4.50��10-3 | 2.50��10-3 | 1.50��10-3 | 1.50��10-3 |
c(CO)/molL-1 | 9.00��10-3 | 4.00��10-3 | 2.00��10-3 | 1.00��10-3 | 1.00��10-3 |
���������գ�
��1�� д���÷�Ӧ��ƽ�ⳣ������ʽ��_________�� �¶����ߣ�������̼�����Ũ�Ƚ�______����������С�����䡱����
��2��ǰ 2s �ڵĵ�����ƽ����Ӧ�����ǣ�v(N2)=______mol/(Ls)���ﵽƽ��ʱ��CO ��ת����Ϊ��_____��
��3����ҵ�ϳ����á� ���³����������������� ������ͬʱ���� SO2 �͵������������壨NOx �����Ի��(NH4)2SO4 ��ϡ��Һ���ڴ���Һ�У�ˮ�ĵ���̶����ܵ���_____����ٽ����������ơ���û��Ӱ�족����
����(NH4)2SO4��Һ���ټ�������ϡ���ᣬ��![]() ֵ��_____����������С�����䡱����
ֵ��_____����������С�����䡱����
��4������� BaCl2 ��Һ��ͨ������ SO2 ���壬û�г������ɣ������μ�һ�����İ�ˮ��������ɰ�ɫ��������ƽ���ƶ�ԭ��������������___________________________��
��5������һ�ֿ����Ա�����Һ��ͨ������ SO2 ���壬������������ɫ�������ó����Ļ�ѧʽΪ_____�� ԭ�����Ա��ο�����_____��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪ Ca(OH)2 �� Cl2 ��Ӧ�������������¶��йأ���һ������ʯ������ͨ������������������ǡ����ȫ��Ӧ������ Cl-��ClO-��ClO3- ���ֺ���Ԫ�ص����ӣ����� ClO- ��ClO3- �������ӵ����ʵ���(n)�뷴Ӧʱ��
(t)��������ͼ��ʾ��

��1��t1 ʱ����ʼ�� ClO3-���ɵ�ԭ����_____��
��2��t2 ʱ��Ca(OH)2 �� Cl2 ������Ӧ���ܵĻ�ѧ����ʽΪ___________��
��3����ʯ�����к��� Ca(OH)2 �����ʵ�����________mol��
��4������Ӧ��������䣬��ij�¶���ǡ����ȫ��Ӧʱ�����������ֵΪ![]() a ���� n(Cl-)=_____mol
a ���� n(Cl-)=_____mol
���ú� a �Ĵ���ʽ����ʾ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���±���Ԫ�����ڱ���һ���֣���Ա��еĢ٢���Ԫ�أ���д���пհף�
���� | IA | IIA | ��A | IVA | VA | VIA | ��A |
1 | �� | ||||||
2 | �� | �� | �� | ||||
3 | �� | �� | �� | �� | �� | �� |
(1)����Ԫ���У��γɻ���������������______(��Ԫ�ط���)��
(2)Ԫ�آ١��ܺ͢��γɵĻ�����ĵ���ʽ��______���û������д��ڵĻ�ѧ��������______��
(3)�ڡ��ۡ�������Ԫ��ԭ�Ӱ뾶�ɴ�С��˳����______(��Ԫ�ط��ű�ʾ)��
�ݡ��ޡ��ߡ��ࡢ�ᡢ������Ԫ���γɵļ����ӣ��뾶��С����_________��������___________(�����ӷ���)��
(4)�ݡ��ޡ�������Ԫ�����{���������Ӧˮ����ļ�����ǿ������˳����______(�ö�Ӧ���ʵĻ�ѧʽ��ʾ)��
(5)�����γ����Ӽ�������Ԫ�ش�����_____________��
(6)�ܱȽ�Ԫ�آ�͢�ǽ�����ǿ����ʵ����ʵ��______(����ĸ���)��
a������⻯������ԱȢ���⻯���������
b����ĵ���R2��H2���ϱȢ�ĵ���Q��H2�������ף���HR���ȶ��Ա�H2Qǿ
c���ڢ���⻯��H2Q��ˮ��Һ��ͨ������ĵ���R2������û�������Q
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ҹ����úϳ���ֱ����ϩ�����ش�ͻ�ƣ���ԭ����
��Ӧ�٣�C(s)��1/2O2(g) = CO(g)����H1
��Ӧ�ڣ�C(s)��H2O(g) = CO(g)��H2(g)����H2
��Ӧ�ۣ�CO(g)��2H2(g) = CH3OH(g)����H3����90.1 kJ��mol��1
��Ӧ�ܣ�2CH3OH(g) = CH3OCH3(g)��H2O(g)����H4�������仯��ͼ��ʾ
��Ӧ�ݣ�3CH3OH(g)= CH3CH=CH2(g)��3H2O(g)����H5����31.0 kJ��mol��1
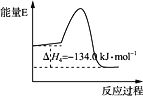
����˵����ȷ����
A. ��Ӧ��ʹ�ô�������H3��С
B. ��Ӧ��������Ӧ�Ļ�ܴ����淴Ӧ�Ļ��
C. ��H1����H2<0
D. ��Ӧ���ͷ�Ӧ������ȡ������CO����������;�������ĵ���������ͬ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ǰ18��Ԫ����ɵ���ѧ��������A��B��C��D��E��X������ͼת����ϵ������������ͷ�Ӧ������ȥ�������ƶϲ���ȷ���ǣ�������
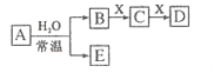
A. ��DΪ��ɫ��������AĦ��������ȣ���Xһ���Ǻ���Ԫ�ص���
B. ��A�ǵ��ʣ�B��D�ķ�Ӧ��OH-+HCO3-=CO32-+H2O����Eһ���ܻ�ԭFe2O3
C. ��DΪCO��C�ܺ�E��Ӧ����Aһ��ΪNa2O2�����������������ӱ�Ϊ2:1
D. ��X��Na2CO3��CΪCO2���ӣ���Aһ������������D��E����Ӧ
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com