
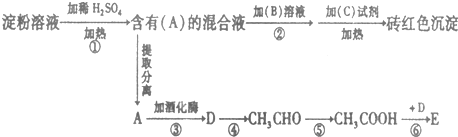
 ;
;分析 淀粉水解生成葡萄糖,则A为葡萄糖,葡萄糖在一定条件下反应生成葡萄糖酸钙,葡萄糖在酒化酶作用下反应生成乙醇,则D结构简式为C2H5OH,C2H5OH被氧化生成CH3CHO,乙醛被氧化生成CH3COOH,C2H5OH、CH3COOH在浓硫酸作催化剂、加热条件下发生酯化反应生成CH3COOC2H5,E为CH3COOC2H5,向A溶液中加入B溶液、再加入C试剂得到砖红色沉淀,淀粉水解是在酸性条件下,醛基和新制氢氧化铜悬浊液反应需要碱性条件,所以B为NaOH,C为新制Cu(OH)2悬浊液,据此分析解答.
解答 解:淀粉水解生成葡萄糖,则A为葡萄糖,葡萄糖在一定条件下反应生成葡萄糖酸钙,葡萄糖在酒化酶作用下反应生成乙醇,则D结构简式为C2H5OH,C2H5OH被氧化生成CH3CHO,乙醛被氧化生成CH3COOH,C2H5OH、CH3COOH在浓硫酸作催化剂、加热条件下发生酯化反应生成CH3COOC2H5,E为CH3COOC2H5,向A溶液中加入B溶液、再加入C试剂得到砖红色沉淀,淀粉水解是在酸性条件下,醛基和新制氢氧化铜悬浊液反应需要碱性条件,所以B为NaOH,C为新制Cu(OH)2悬浊液,
(1)醛基和氢氧化铜悬浊液的反应必须是碱性条件下进行,淀粉水解在酸性条件下进行,所以要加入氢氧化钠溶液中和稀硫酸而使溶液呈碱性,
故答案为:中和稀硫酸;
(2)D为乙醇,D中含有的官能团为羟基,羟基中O原子和H原子之间共用一对电子,且O原子还含有一个孤电子,则羟基的电子式 ,
,
故答案为:羟基、 ;
;
(3)葡萄糖在酒化酶作用下反应生成乙醇,则D结构简式为C2H5OH,乙醇与Na反应生成乙醇钠和氢气,反应方程式为,2C2H5OH+2Na→2C2H5ONa+H2↑,
故答案为:2C2H5OH+2Na→2C2H5ONa+H2↑;
(4)C2H5OH被氧化生成CH3CHO,乙醛被氧化生成CH3COOH,反应方程式分别为,反应方程式为,(5)该反应为乙醇、乙酸在浓硫酸作催化剂、加热条件下发生酯化反应生成乙酸乙酯和水,反应方程式为2CH3CH2OH+O2 $→_{△}^{Cu}$2CH3CHO+2H2O,2CH3CHO+O2$\stackrel{催化剂}{→}$2CH3COOH,
故答案为:2CH3CH2OH+O2 $→_{△}^{Cu}$2CH3CHO+2H2O;2CH3CHO+O2$\stackrel{催化剂}{→}$2CH3COOH.
点评 本题考查有机物推断,涉及醇、醛、羧酸、酯之间的转化,明确物质中官能团及其性质是解本题关键,熟练掌握卤代烃、烯、醇、醛、羧酸、酯的反应特点,题目难度中等.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | B与A只能组成BA3化合物 | |
| B. | 第三周期中,D原子的原子半径最大 | |
| C. | A、B、C三元素不可能形成离子化合物 | |
| D. | E的氧化物对应水化物一定有强的氧化性 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 给盛有2/3体积液体的试管加热 | |
| B. | CuSO4溶于水,可将含有CuSO4的废液倒入水槽中,再用水冲入下水道 | |
| C. | 用蒸发方法使NaCl从溶液中析出时,应将蒸发皿中NaCl溶液全部加热蒸干 | |
| D. | 实验时将剩余的钠放回原试剂瓶 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H2S与SO2、NO与O2、NH3与Cl2在常温下均不能大量共存 | |
| B. | SiO2化学性质相对稳定,在一定条件下也能与某些非金属单质、酸、碱、盐反应 | |
| C. | Fe(OH)3、FeCl2、FeCl3、NO、H2SiO3均可通过化合反应得到 | |
| D. | AlCl3、Fe3O4、NaOH都可通过置换反应一步得到也可通过化合反应一步得到 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.04 0.04 | B. | 0 0.04 | C. | 0.2 0.2 | D. | 0 1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 如图为某品牌酱油标签的一部分:
如图为某品牌酱油标签的一部分:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1.5mol/L | B. | 2mol/L | C. | 1mol/L | D. | 无法确定 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com