
| A. | 0.40 mol | B. | 0.20 mol | ||
| C. | 小于0.20mol | D. | 大于0.20 mol,小于0.40 mol |
分析 达平衡后移走1.0mol H2和0.50mol I2(g),重新到达的平衡,可以等效为开始加入1.0mol H2和0.50mol I2(g)到达的平衡,与原平衡相比压强减小,平衡不移动,反应物的转化率相等,故平衡时HI的物质的量等于原平衡的$\frac{1}{2}$倍,由此分析解答.
解答 解:达平衡后移走1.0mol H2和0.50mol I2(g),重新到达的平衡,可以等效为开始加入1.0mol H2和0.50mol I2(g)到达的平衡,与原平衡相比压强减小,平衡不移动,反应物的转化率相等,故平衡时HI的物质的量等于原平衡的$\frac{1}{2}$倍,所以0.40mol×$\frac{1}{2}$=0.2mol,故选B.
点评 考查化学平衡的有关减小,化学平衡的建立等,难度中等,关键是设计等效平衡建立的途径.


 举一反三同步巧讲精练系列答案
举一反三同步巧讲精练系列答案 口算与应用题卡系列答案
口算与应用题卡系列答案科目:高中化学 来源: 题型:选择题
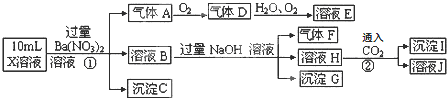
| A. | 气体F不能与溶液E发生反应 | |
| B. | X中肯定存在Fe2+、Al3+、NH4+、SO42- | |
| C. | X中肯定不存在CO32-、SO32-、Cl- | |
| D. | X中不能确定的离子是Al3+和Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 弱酸 | 电离平衡常数(25℃) |
| HClO | K=2.98×10-8 |
| H2CO3 | K1=4.3×10-7 K2=5.6×10-11 |
| H2SO3 | K1=1.54×10-2 K2=1.02×10-7 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
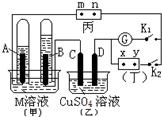 如图所示的实验装置,丙为酚酞溶液润湿的淀粉碘化钾试纸,m、n为夹在滤纸两端的铂夹.丁为直流电源,x、y为电源的两极.G为电流计,电极均为石墨电极.闭合K2、断开K1,一段时间后,A极产生的气体体积为44.8ml、B极产生的气体体积为22.4ml(都已换算成标况下的体积),回答下列问题:
如图所示的实验装置,丙为酚酞溶液润湿的淀粉碘化钾试纸,m、n为夹在滤纸两端的铂夹.丁为直流电源,x、y为电源的两极.G为电流计,电极均为石墨电极.闭合K2、断开K1,一段时间后,A极产生的气体体积为44.8ml、B极产生的气体体积为22.4ml(都已换算成标况下的体积),回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:填空题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CO2通过Na2O2使其增重b g时,反应中转移电子数为bNA/44 | |
| B. | 18 g D2O中含有质子的数目为NA | |
| C. | 12 g C3H6 与 16 g C2H4的混合物完全燃烧,可生成CO2分子数为2 NA | |
| D. | 0.1 mol AlCl3完全水解转化为氢氧化铝胶体,生成 0.1 NA个胶粒 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com