

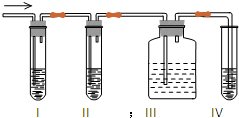
 ,
, ;
;| 一定条件 |
| Cu |
| △ |
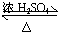 CH3COOCH2CH3+H2O,
CH3COOCH2CH3+H2O,| 一定条件 |
| Cu |
| △ |
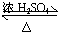 CH3COOCH2CH3+H2O;
CH3COOCH2CH3+H2O;

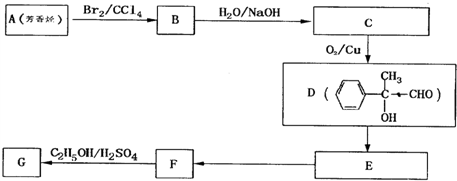
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 盐酸 |
| 蒸馏 |
| 一定条件 |
| 用标准溶液滴定 |
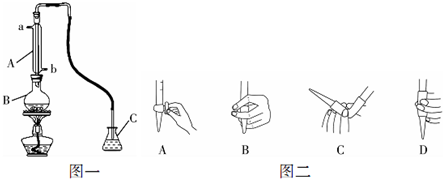
查看答案和解析>>
科目:高中化学 来源: 题型:
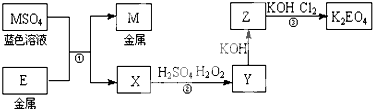
| 放电 |
| 充电 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| t℃ | 700 | 800 | 850 | 1000 | 1200 |
| K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、用酒精萃取碘水中的碘 |
| B、蒸馏时,应使温度计水银球靠近蒸馏烧瓶支管口 |
| C、分液时,分液漏斗中下层液体从下口放出,上层液体从上口倒出 |
| D、配制浓H2SO4和浓HNO3的混酸时,应将H2SO4慢慢加到浓HNO3中,并及时搅拌和冷却 |
查看答案和解析>>
科目:高中化学 来源: 题型:
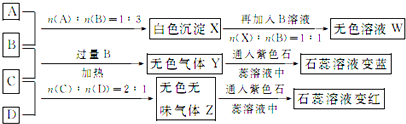
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、大于7或等于7 |
| B、小于7 |
| C、小于7或等于7 |
| D、无法确定 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com