
分析 (1)根据反应物与生成物来书写反应方程式,即由软锰矿与过量固体KOH和KClO3在高温下反应,生成锰酸钾(K2MnO4)和KCl来书写;
(2)根据反应物与生成物来书写反应方程式,即由滤液酸化后,K2MnO4转变为MnO2和KMnO4;滤去MnO2沉淀,浓缩滤液,结晶得到深紫色的针状KMnO4来书写;
(3)利用化学反应方程式及二氧化锰的质量代入计算;
(4)根据KMnO4能与热的经硫酸化的Na2C2O4反应生成Mn2+和CO2,并利用质量守恒定律来书写反应方程式;
(5)实验室可用二氧化锰作催化剂制取氧气,也可用二氧化锰和浓盐酸共热制取氯气.
解答 解:(1)由软锰矿与过量固体KOH和KClO3在高温下反应,生成锰酸钾(K2MnO4)和KCl,则反应为3MnO2+6KOH+KClO3$\frac{\underline{\;\;△\;\;}}{\;}$3K2MnO4+KCl+3H2O,
故答案为:3MnO2+6KOH+KClO3$\frac{\underline{\;\;△\;\;}}{\;}$3K2MnO4+KCl+3H2O;
(2)由滤液酸化后,K2MnO4转变为MnO2和KMnO4,则反应为3MnO42-+4H+═MnO2↓+2MnO4-+2H2O,
故答案为:3MnO42-+4H+═MnO2↓+2MnO4-+2H2O;
(3)由3MnO2+6KOH+KClO3$\frac{\underline{\;\;△\;\;}}{\;}$3K2MnO4+KCl+3H2O、3MnO42-+4H+═MnO2↓+2MnO4-+2H2O可知,反应物和生成物间的计量关系为:
MnO2→K2MnO4→$\frac{2}{3}$KMnO4
87 158×$\frac{2}{3}$
2.5×80% x
x=$\frac{158g/mol×\frac{2}{3}×2.5g×80%}{87g/mol}$=2.4g,
答:KMnO4的理论产量是2.4g;
(4)由KMnO4能与热的经硫酸化的Na2C2O4反应生成Mn2+和CO2,则反应为2KMnO4+5Na2C2O4+8H2SO4 $\frac{\underline{\;\;△\;\;}}{\;}$K2SO4+2MnSO4+5Na2SO4+10CO2↑+8H2O,
故答案为:2KMnO4+5Na2C2O4+8H2SO4 $\frac{\underline{\;\;△\;\;}}{\;}$K2SO4+2MnSO4+5Na2SO4+10CO2↑+8H2O;
(5)软锰矿(主要成分为MnO2),可用于制取氧气、氯气,如实验室制取氯气是二氧化锰和浓盐酸共热,反应的方程式为:MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O,
故答案为:MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O.
点评 本题考查化学反应方程式的书写及有关氧化还原反应的计算,明确反应物与生成物及物质之间的关系是解答的关键,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 该反应是一熵减反应 | |
| B. | 升高温度时,反应向逆方向进行 | |
| C. | 反应平衡时,v (CO2):v (CO)=1:2 | |
| D. | 充入N2使体系压强增大,能提高反应速率 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NH4+、Mg2+、SO42-、Cl- | B. | Ba2+、K+、OH-、NO3- | ||
| C. | Al3+、Cu2+、SO42-、Cl- | D. | Na+、Ca2+、Cl-、[Al(OH)4]- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 古剑“沈卢”“以剂钢为刃,柔铁为茎干,不尔则多断折”,剂钢指的是铁的合金 | |
| B. | 制造新版人民币所使用的棉花、优质针叶木等原料的主要成分是纤维素 | |
| C. | 为了增强漂白粉的使用效果,在使用漂白粉时必须和盐酸混合使用 | |
| D. | “青蒿一握,以水二升渍,绞取汁”,该过程对青蒿素的提取属于物理变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 (代号DMP)是一种常用的酯类塑化剂,其蒸汽对氢气的相对密度为97.工业上生产DMP的流程如图所示:
(代号DMP)是一种常用的酯类塑化剂,其蒸汽对氢气的相对密度为97.工业上生产DMP的流程如图所示:
 的名称1,2-二甲苯(或邻二甲苯),C中官能团的名称为醛基.
的名称1,2-二甲苯(或邻二甲苯),C中官能团的名称为醛基.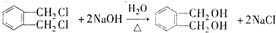 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 反应物和生成物都是非极性分子 | |
| B. | 0.5molHCHO 含有1molσ键 | |
| C. | HCHO、CO2分子中中心原子杂化类型相 | |
| D. | 液态水中只存在一种作用力同 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 醇在Cu或Ag的催化作用下都可以氧化 | |
| B. | 乙醇的分子间脱水反应属于取代反应 | |
| C. | 醇都可以在浓H2SO4作用下以及170℃时发生消去反应 | |
| D. | 一元饱和脂肪醇的化学式都可以用通式CnH2n+2O2表示 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 装置漏气 | |
| B. | 镁带称量后擦去表面氧化膜 | |
| C. | 测定时氢气的实际温度高于记录温度数值 | |
| D. | 镁带中含有不溶于酸的杂质 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 第七周期元素共有50种 | |
| B. | 该元素原子的质量数是184 | |
| C. | 该元素的相对原子质量是298 | |
| D. | 该元素的原子核外有114个电子,最外层有4个电子 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com