
【题目】将0.050molSO2(g)和0.030molO2(g)放入容积为1L的密闭容器中,反应2SO2(g)+O2(g)2SO3(g)△H<0,在一定条件下达到平衡,测得c(SO3)=0.040mol/L.
(1)该条件下反应的平衡常数K的数值为 , 如升高温度,则K值(填“增大”、“减小”或“不变”).
(2)在其他条件不变时
①若增大O2的浓度,则SO2的转化率(填“增大”或“减小”);
②若升高温度,则平衡(填字母代号);
A.不移动 B.向正反应方向移动 C.向逆反应方向移动
③欲使平衡向正反应方向移动且反应速率加快,下列措施可行的是 . (填字母代号)
A.向平衡混合物中充入Ar B.向平衡混合物中充入O2
C.使用催化剂V2O5 D.降低反应的温度.
【答案】
(1)1.6×103;减小
(2)增大;C;B
【解析】解:(1)将0.050molSO2(g)和0.030molO2(g)放入容积为1L的密闭容器中,反应:2SO2(g)+O2(g)2SO3(g) 在一定条件下达到平衡,测得c(SO3)=0.040mol/L,则
2SO2(g) | + | O2(g) | 2SO3(g) | ||
起始量(mol/L) | 0.05 | 0.03 | 0 | ||
变化量(mol/L) | 0.04 | 0.02 | 0.04 | ||
平衡量(mol/L) | 0.01 | 0.01 | 0.04 |
平衡常数= ![]() =1.6×103;
=1.6×103;
该反应为放热反应,升高温度平衡向逆反应方向移动,平衡常数减小,
所以答案是:1.6×103;减小;(2)①增大氧气的浓度,可使平衡正向移动,则二氧化硫的转化率增大,所以答案是:增大;
②正反应为放热反应,则升高温度,平衡逆向移动,所以答案是:C;
③A.向平衡混合物中充入Ar,平衡不移动,故A错误;
B.向平衡混合物中充入O2 , 平衡正向移动,故B正确;
C.使用催化剂V2O5 , 平衡不移动,故C错误;
D.降低反应的温度,反应速率减小,故D错误.
所以答案是:B.
【考点精析】本题主要考查了化学平衡状态本质及特征和化学平衡的计算的相关知识点,需要掌握化学平衡状态的特征:“等”即 V正=V逆>0;“动”即是动态平衡,平衡时反应仍在进行;“定”即反应混合物中各组分百分含量不变;“变”即条件改变,平衡被打破,并在新的条件下建立新的化学平衡;与途径无关,外界条件不变,可逆反应无论是从正反应开始,还是从逆反应开始,都可建立同一平衡状态(等效);反应物转化率=转化浓度÷起始浓度×100%=转化物质的量÷起始物质的量×100%;产品的产率=实际生成产物的物质的量÷理论上可得到产物的物质的量×100%才能正确解答此题.


科目:高中化学 来源: 题型:
【题目】如图是Zn和Cu形成的原电池,下列描述合理的是( )
①Cu为阳极,Zn为阴极
②Cu极上有气泡产生
③SO42﹣向Cu极移动
④若有0.5mol电子流经导线,则可产生0.25mol气体
⑤电子的流向是:Cu→导线→Zn ⑥正极反应式:Cu+2e﹣═Cu2+ . 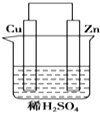
A.①②③
B.②④
C.④⑤⑥
D.③④⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E五种元素中,A原子核外的M层中只有两对成对电子,B原子核外的L层电子数是K层的两倍,C是地壳内含量(质量分数)最高的元素,D的核电荷数是A与C的核电荷数之和,E在元素周期表的各元素中电负性最大.请回答下列问题:
(1)A、B的元素符号依次为、;
(2)AC2与BC2分子的立体结构分别是和 , 相同条件下两者在水中的溶解度较大的是(写分子式),理由是;
(3)D的核外电子排布式为 , 在形成化合物时它的最高化合价为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在标准状况下,将11.2L氢气在氯气中完全燃烧,放出92.4KJ热量,则该反应的热化学方程式是( )
A.H2(g)+Cl2(g)═ ![]() HCl(g)△H=+92.4KJ/mol
HCl(g)△H=+92.4KJ/mol
B.H2(g)+Cl2(g)═ ![]() HCl(g)△H=﹣92.4KJ/mol
HCl(g)△H=﹣92.4KJ/mol
C.H2(g)+Cl2(g)═2HCl(g)△H=﹣184.8KJ/mol
D.H2(g)+Cl2(g)═2HCl(l)△H=+184.8 KJ/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钢铁是目前用量最大、用途最广的金属材料,但钢铁容易生锈. 
(1)某同学取一颗光亮的铁钉按图甲装置实验.数天后,试管内可观察到的现象是(填字母代号).
A.铁钉不生锈,液面上升
B.铁钉生锈,液面上升
C.铁钉生锈,液面下升
(2)铁表面镀锌可以增强铁的耐腐蚀性.铁片镀锌的装置图如乙,其中铁片作极(填“阳”或“阴”),锌片上的电极反应式是 .
(3)如图丙在盛有水的烧杯中,铁圈和银圈的连接处吊着一根绝缘的细丝,使之平衡.小心地从烧杯中央滴入硫酸铜溶液.片刻后可观察到的现象是(指悬吊的金属圈)(填字母代号);
A.铁圈和银圈左右摇摆不定
B.保持平衡状态不变
C.铁圈向下倾斜
D.银圈向下倾斜
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列变化过程中,△S<0的是( )
A.NH3(g)与HCl(g)反应生成NH4Cl(s)
B.氯化钠溶于水中
C.CaCO3(S)分解为CaO(S)和CO2(g)
D.干冰(CO2)的升华
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学兴趣小组丙为探究Fe3+是否能氧化SO2 , 设计了如图实验装置. 
(1)如上图连接好装置.实验前应进行操作
(2)观察到装置C中产生了白色沉淀,同学们提出了以下猜想(每个猜想只考虑一种物质的氧化性).
猜想1:;
猜想2:SO2被Fe3+氧化了;
猜想3:SO2被NO3﹣氧化了
(3)甲同学认为猜想1正确,并利用上述装置A进行了排除干扰的探究实验.
乙同学认为猜想2正确,则装置C中反应的离子方程式是
(4)丙同学认为猜想3正确,他利用甲同学的实验装置,设计实验验证猜想.请在表格中写出实验步骤以及预期现象和结论.限选实验试剂:NaNO3溶液、KSCN溶液、FeCl3溶液、BaCl2溶液、Fe(NO3)3溶液
实验步骤 | 预期现象和结论 |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各项表述得不够科学严密的是( )
A.有电子转移(得失或偏移)的化学反应都是氧化还原反应
B.p电子原子轨道的平均半径随电子层的增大而增大
C.电子是在原子核外,能量由低到高的不同电子层上分层排布的
D.氢原子电子云图中小黑点表示电子的运动轨迹
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用芳香烃X和烯烃Y可以合成紫外线吸收剂BAD.
已知:G不能发生银镜反应,B遇FeCl3溶液显紫色,C到D的过程为引入羧基(﹣COOH)的反应.其中BAD结构简式为: 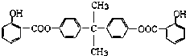
BAD的合成路线如下: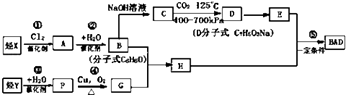
试回答下列问题:
(1)写出结构简式YD .
(2)属于加成反应的有(填数字序号) .
(3)1molBAD最多可与含molNaOH的溶液完全反应.
(4)写出方程式反应④ . F+E .
(5)E有多种同分异构体,判断符合下列要求的同分异构体数目为种.
①能发生银镜反应②遇FeCl3溶液显紫色③核磁共振氢谱图中有四个吸收峰.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com