
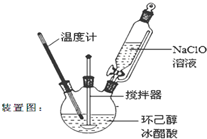
 环己酮是重要化工原料,是制造尼龙、己内酰胺和己二酸的主要中间体.某化学兴趣小组尝试用次氯酸钠制备环己酮.方程式为:
环己酮是重要化工原料,是制造尼龙、己内酰胺和己二酸的主要中间体.某化学兴趣小组尝试用次氯酸钠制备环己酮.方程式为: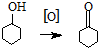
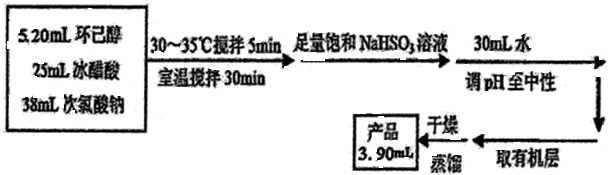
分析 (1)根据反应流程提供的反应物体积可知,反应物总体积约为5.2mL+25mL+38mL=68.2mL,而三颈瓶中液体的体积不能超过容积的$\frac{2}{3}$不少于$\frac{1}{3}$,据此答题;
(2)搅拌加速热量传递,NaClO水解吸热;
(3)次氯酸根能将亚硫酸氢根氧化,已经足量时溶液中无次氯酸根,可以用碘化钾淀粉试纸检验是否有次氯酸根;
(4)由(3)中分析可知溶液呈酸性;
(5)环己酮在氯化钠中的溶解度较小,环己酮和水互不相溶.
解答 解:(1)根据反应流程提供的反应物体积可知,反应物总体积约为5.2mL+25mL+38mL=68.2mL,而三颈瓶中液体的体积不能超过容积的$\frac{2}{3}$,实验用的三颈瓶应选用150mL规格,故答案为:B;
(2)为了将体系温度维持在30~35℃,要不断搅拌加速热量传递,而且NaClO水解吸热,因此要缓慢滴加NaClO溶液,
故答案为:搅拌器搅拌;缓慢滴加NaClO溶液;
(3)次氯酸根能将亚硫酸氢根氧化生成氯离子、硫酸根离子和氢离子,其离子方程式为:ClO-+HSO3-═Cl-+H++SO42-;确保加入的饱和NaHSO3溶液已经足量,可以取少量烧瓶中的液体,加入碘化钾淀粉溶液,若看到溶液不显蓝色,则NaHSO3溶液已足量,
故答案为:ClO-+HSO3-═Cl-+H++SO42-;碘化钾淀粉溶液;溶液不显蓝色;
(4)由(3)中分析可知溶液呈酸性,可加入无水碳酸钠或氢氧化钠固体,可以使溶液变为中性,
故答案为:BD;
(5)环己酮在氯化钠中的溶解度较小,有利于环己酮分层;环己酮和水互不相溶,可用分液漏斗分离,
故答案为:降低环己酮的溶解度,有利于环己酮分层;分液漏斗.
点评 本题以环己酮制备为载体,考查化学实验基本操作、离子反应、关系式计算等,题目难度中等,关键根据实验流程利用氧化还原反应判断发生的离子反应,是对学生综合能力的考查.


 新非凡教辅冲刺100分系列答案
新非凡教辅冲刺100分系列答案科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| 容器 | 甲 | 乙 | 丙 |
| 反应物投入量 | 1mol CO、2mol H2 | 1mol CH3OH | 2mol CH3OH |
| CH3OH的浓度(mol/L) | c1 | c2 | c3 |
| 反应的能量变化 | 放出a kJ | 吸收b kJ | 吸收c kJ |
| 平衡时压强(Pa) | P1 | P2 | P3 |
| 反应物转化率 | α1 | α2 | α3 |
| A. | c1=c3 | B. | a+c/2<90.7 | C. | 2P2>P3 | D. | α1+α3=1 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ②④ | B. | ①② | C. | ③⑤ | D. | ④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
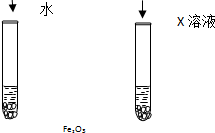 氧化铁可溶于稀盐酸.某同学想知道是稀盐酸中的哪种粒子(H2O、H+、Cl-)能使氧化铁溶解.设计如下实验:
氧化铁可溶于稀盐酸.某同学想知道是稀盐酸中的哪种粒子(H2O、H+、Cl-)能使氧化铁溶解.设计如下实验:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com