
分析 求出混合溶液中硫酸的物质的量和混合后溶液的体积,然后根据物质的量浓度C=$\frac{n}{V}$来计算.
解答 解:将100mL0.3mol/L和300mL0.25mol/L的硫酸溶液混合后,溶液体积变为400mL,溶液中硫酸的物质的量n=0.3mol/L×0.1L+0.25mol/L×0.3L=0.105mol,故混合溶液中硫酸的物质的量浓度C=$\frac{n}{V}$=$\frac{0.105mol}{0.4L}$=0.2526mol/L.
答:所得混合溶液中硫酸的浓度为0.2526mol/L.
点评 本题考查了混合溶液中物质的量浓度的相关计算,审题时应分清楚溶液混合后是发生了化学反应还是两溶液简单混合,难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 化学变化的同时总伴随着能量变化 | |
| B. | 需加热才反应的一定是吸热反应 | |
| C. | 在常温下就能进行的反应一定是放热反应 | |
| D. | 反应物的总能量大于生成物的总能量的反应是吸热反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,11.2L四氯化碳所含分子数为0.5 NA | |
| B. | 1mol/L的盐酸溶液中,所含氯化氢分子数为NA | |
| C. | 80g硝酸铵含有氮原予数为2NA | |
| D. | 1mol氯气和铁反应时转移的电子数为3NA |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
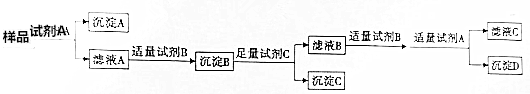
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 电解饱和食盐水时,阳极的电极反应式为:2Cl--2e-=Cl2↑ | |
| B. | 氢氧燃料电池的负极反应式:O2+2H2O+4e-=4OH- | |
| C. | 在铁的表面镀上一层锌,铁作阳极,电极反应式为:Zn2++2e-=Zn | |
| D. | 钢铁发生电化学腐蚀的正极反应式:Fe-2e-=Fe2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Al4C3晶体,熔点2200℃,熔融态不导电 | |
| B. | C3N4晶体具有比金刚石还大的硬度 | |
| C. | VF5晶体易溶于一些有机溶剂中 | |
| D. | BaCl2熔融状态下能够导电 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 检验亚硫酸钠试样是否变质:试样$\stackrel{溶解}{→}$ $\stackrel{硝酸钡溶液}{→}$白色沉淀$\stackrel{稀硝酸}{→}$沉淀不溶 | |
| B. | 检验某卤代烃是否是氯代烃:试样$→_{煮沸}^{氢氧化钠溶液}$ 冷却 $\stackrel{稀硫酸至酸性}{→}$ $\stackrel{硝酸银溶液}{→}$出现白色沉淀 | |
| C. | 证明酸性条件H2O2氧化性比I2强:NaI溶液$\stackrel{30%H_{2}O_{2}溶液}{→}$ $\stackrel{稀硝酸及淀粉}{→}$溶液变蓝色 | |
| D. | 除去氯化钠晶体中少量硝酸钾:试样$\stackrel{加适量水溶解}{→}$ $\stackrel{蒸发到剩少量液体}{→}$ $\stackrel{趁热过滤}{→}$ $\stackrel{洗涤晶体}{→}$再重结晶 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com