
| A. | 酸碱中和滴定时,用待测液润洗锥形瓶. | |
| B. | 酸碱中和滴定时,用冲洗干净的滴定管盛装标准溶液 | |
| C. | 用NaOH标准溶液测定未知度的盐酸时,选用酚酞作指示剂,实验时不小心多加了几滴 | |
| D. | 用标准盐酸测定未知浓度NaOH结束实验,酸式滴定管尖嘴部分有气泡,开始实验时无气泡 |
分析 A.锥形瓶用蒸馏水洗后,不能用待测润洗,否则待测液的物质的量增加,测定结果偏大;
B.酸碱中和滴定时,滴定管水洗后,应用盛装的标准液润洗滴定管,然后再盛装标准溶;
C.用NaOH标准溶液测定未知度的盐酸时,选用酚酞作指示剂,实验时不小心多加了几滴,对实验结果基本无影响;
D.用标准盐酸测定未知浓度NaOH结束实验,酸式滴定管尖嘴部分有气泡,开始实验时无气泡,滴定终点时的气泡将滴定管里的液面上升,影响测定结果.
解答 解:A.用蒸馏水洗净滴定管后,必须再用标准液盐酸润洗滴定管,避免滴定管内的水分将标准液稀释了,标准液浓度减小,滴定时消耗体积增大,测定结果偏大,故A错误;
B.酸碱中和滴定时,滴定管水洗后,直接盛装标准液,标准液的浓度会稀释而降低,导致测定浓度偏高,故需要先用标准液润洗滴定管,然后再盛装标准溶;故B错误;
C.用NaOH溶液滴定未知浓度盐酸时选用酚酞作指示剂,多加几滴,对实验结果无影响,不产生误差,故C正确;
D.滴定终点时酸式滴定管尖嘴部分有气泡,开始实验时无气泡,测定所需的标准液的体积减小,导致测定浓度偏低,故D错误;
故选:C.
点评 本题考查了中和滴定的操作方法及误差分析,题目难度中等,明确正确的中和滴定操作方法为解答关键,注意根据操作方法对c(碱)=$\frac{c(酸)×V(酸)}{C(碱)}$产生的影响判断滴定误差.


科目:高中化学 来源: 题型:选择题
| A. | N2的电子式: | |
| B. | 质子数为53、中子数为78的碘原子:${\;}_{53}^{131}$I | |
| C. | S2-的结构示意图: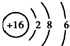 | |
| D. | O原子的基态电子排布式为:1s22s22p${\;}_{x}^{2}$p${\;}_{y}^{2}$p${\;}_{z}^{0}$. |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 1mol 任何物质所含的分子数均为NA | |
| B. | 14g氮气所含的氮原子数为NA | |
| C. | 44gCO2与28gCO所含的分子数均为NA | |
| D. | NA个氢气分子和NA个氯气分子的质量比为1:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
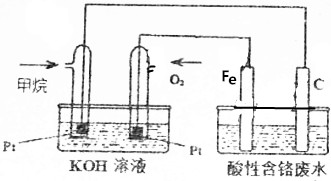
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.5molH2SO4与0.5molBa(OH)2完全反应所放出的热量,即为中和热 | |
| B. | 加入催化剂,活化分子的百分含量和数目都增大,从而反应速率增大 | |
| C. | NaCl溶液能导电,所以NaCl溶液是电解质 | |
| D. | 牺牲阳极的阴极保护法,是根据电解原理防护金属腐蚀 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 肯定有Al3+、Mg2+、NO3-,可能有NH4+、K+ | |
| B. | 肯定有Al3+、K+、Cl-,肯定没有MnO4-、Mg2+ | |
| C. | 肯定有Al3+、NH4+、Cl-、NO3-,一定没有HCO3-、Mg2+、MnO4- | |
| D. | 该溶液可能显弱酸性,也可能显中性 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 3种 | B. | 4种 | C. | 5种 | D. | 6种 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com