
分析 Fe在氯气中燃烧生成三氯化铁,三氯化铁溶于水形成棕黄色溶液;氢气在氯气中燃烧生成HCl,据此分析.
解答 解:Fe在氯气中燃烧生成三氯化铁,集气瓶中充满红棕色的烟,三氯化铁溶于水形成棕黄色溶液,气反应方程式为2Fe+3Cl2$\frac{\underline{\;点燃\;}}{\;}$2FeCl3;
氢气在氯气中燃烧产生苍白色火焰,生成HCl,其反应方程式为:H2+Cl2$\frac{\underline{\;点燃\;}}{\;}$2HCl;
故答案为:产生红棕色的烟;红棕色的烟溶于水形成棕黄色的溶液;产生苍白色火;2Fe+3Cl2$\frac{\underline{\;点燃\;}}{\;}$2FeCl3,H2+Cl2$\frac{\underline{\;点燃\;}}{\;}$2HCl.
点评 本题为铁及其化合物的性质实验、氢气在氯气中燃烧的实验,掌握铁、氢气和氯气反应的原理和有关现象是解答的关键,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | CO2+H2O=H2CO3和H2CO3=CO2+H2O | |
| B. | 2H2O$\frac{\underline{\;通电\;}}{\;}$2H2↑+O2↑和2H2+O2$\frac{\underline{\;点燃\;}}{\;}$2H2O | |
| C. | 2SO2+O2$\frac{\underline{催化剂}}{△}$2SO3和2SO3$\frac{\underline{催化剂}}{△}$2SO2+O2 | |
| D. | H2+I2$\frac{\underline{\;\;△\;\;}}{\;}$2HI和2HI$\frac{\underline{\;\;△\;\;}}{\;}$H2+I2 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 选用试剂 | 实验现象 | |
| 第一种方法 | C | 有机层(下层)无色 |
| 第二种方法 | D | 溶液呈血红色 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 实验操作及现象 | 实验结论 |
| A | 向某溶液中加入氯化钡溶液,有白色沉淀生成,再加盐酸酸化,沉淀不溶解 | 该溶液中一定含有SO42- |
| B | 浓硫酸滴入蔗糖中,搅拌得黑色蓬松的固体并有刺激性气味 | 该过程中浓硫酸仅体现吸水性和脱水性 |
| C | 在酒精灯上加热铝箔,铝箔熔化,但不滴落,好像有一层膜兜着 | 铝易被氧化;铝的熔点比氧化铝低 |
| D | 向某溶液中加入稀盐酸,产生能使澄清石灰水变浑浊的无色气体 | 该溶液中一定含有CO32- |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

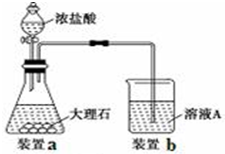

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 质子数为1 | B. | 电子数为3 | C. | 中数为2 | D. | 质量数为3 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com