
【题目】微生物燃料电池是利用微生物作为反应主体,将有机物的化学能转化为电能.如以葡萄糖溶液为例,其工作原理如图所示: 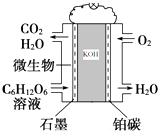
(1)电池工作时,石墨电极上发生(填“氧化”或“还原”)反应,
(2)阳离子移向(填“石 墨”或“铂碳”)电极,
(3)该电池负极电极上反应的电极反应式为 .
(4)当有8mol电子发生转移时消耗的氧气在标况下为L.
【答案】
(1)氧化
(2)铂碳
(3)C6H12O6+36OH﹣﹣24e﹣═6CO32﹣+24H2O
(4)44.8
【解析】解:(1)燃料电池的正极上是氧气发生得电子的还原反应,故石墨为负极,发生氧化反应,所以答案是:氧化;(2)阳离子向正极移动,铂碳为正极,故移向铂碳电极,所以答案是:铂碳;(3)石墨为负极,电极反应式为C6H12O6+36OH﹣﹣24e﹣═6CO32﹣+24H2O,所以答案是:C6H12O6+36OH﹣﹣24e﹣═6CO32﹣+24H2O;(4)正极反应O2+4H++4e﹣=2H2O,当4mol电子转移时消耗1mol氧气,8mol电子转移消耗2mol氧气,标况下体积为2×22.4=44.8L,所以答案是:44.8.


科目:高中化学 来源: 题型:
【题目】20℃时,饱和KCl溶液的密度为1.174gcm﹣3 , 物质的量浓度为4.0molL﹣1 , 则下列说法中不正确的是( )
A.20℃时,饱和KCl溶液与等质量的水混合后物质的量浓度大于2.0molL﹣1
B.20℃时,将29.8 gKCl溶于87.6g水中可得饱和溶液
C.20℃时,密度小于1.174gcm﹣3的KCl溶液是不饱和溶液
D.将此溶液蒸发部分水,再恢复到20℃时,溶液中各离子的浓度不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表为元素周期表的一部分,请参照元素①﹣⑧在表中的位置,用化学用语回答下列问题:
族 | IA | 0 | ||||||
1 | ① | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | |
2 | ② | ③ | ④ | |||||
3 | ⑤ | ⑥ | ⑦ | ⑧ | ||||
(1)④、⑤、⑥的原子半径由大到小的顺序为 .
(2)②、③、⑦的最高价含氧酸的酸性由强到弱的顺序是 .
(3)①、④、⑤、⑧中的某些元素可形成既含离子键又含极性共价键的化合物,写出其中一种化合物的电子式: .
(4)由表中两种元素的原子按1:1组成的常见液态化合物的稀液易被催化分解,可使用催化剂为(填序号) . a.MnO2b.FeCl3 c.Na2SO3 d.KMnO4
(5)用电子式表示①、④两种元素形成18电子的形成过程 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铜及其化合物在科学研究和工业生产中具有许多用途.
(1)纳米氧化亚铜(Cu2O)是一种用途广泛的光电材料,已知高温下Cu2O比CuO稳定,
①画出基态Cu原子的价电子轨道排布图;
②从核外电子排布角度解释高温下Cu2O比CuO更稳定的原因;
(2)CuSO4溶液常用作农药、电镀液等,向CuSO4溶液中滴加足量浓氨水,直至产生的沉淀恰好溶解,可得到深蓝色的透明溶液,再向其中加入适量乙醇,可析出深蓝色的Cu(NH3)4SO4H2O晶体.
①沉淀溶解的离子方程式为;
②Cu(NH3)4SO4H2O晶体中存在的化学键有;
a.离子键 b.极性键 c.非极性键 d.配位键
③SO42﹣的立体构型是 , 其中S原子的杂化轨道类型是;
(3)Cu晶体中原子的堆积方式如图所示(为面心立方最密堆积),则晶胞中Cu原子的配位数为 , 若Cu晶体的晶胞参数a=361.4pm,则Cu晶体的密度是(只用数字列算式) 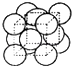
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述正确的是( )
A.在原电池的负极和电解池的阴极上都是发生失电子的氧化反应
B.用惰性电极电解Na2SO4溶液,阴阳两极产物的物质的量之比为1:2
C.用惰性电极电解饱和NaCl溶液,若有1 mol电子转移,则生成1mol NaOH
D.镀层破损后,镀锡铁板比镀锌铁板更耐腐蚀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据题意填空
(1)根据VSEPR模型判断,下列微粒中所有原子都在同一平面上的一组是 .
A.SO32﹣和NO2﹣
B.NO3﹣和SO3
C.H3O+和ClO3﹣
D.PO43﹣和SO32﹣
(2)CaF2的晶胞如图所示. 
①下列有关CaF2的表达正确的是
a.Ca2+与F﹣间仅存在静电吸引作用
b.F﹣的离子半径小于Cl﹣ , 则CaF2的熔点高于CaCl2
c.阴、阳离子比为2:1的离子化合物,均与CaF2晶体构型相同
d.CaF2中的化学键为离子键,因此CaF2在熔融状态下能导电
②CaF2难溶于水,但可溶于含Al3+的溶液中,原因是(用离子方程式表示,已知[AlF6]3﹣在溶液中可稳定存在).
③晶胞中F﹣的配位数是 , 与一个Ca2+等距离且最近的Ca2+有个.
(3)铜、锌两种元素的第一电离能、第二电离能如表所示
电离能/kJmol﹣1 | I1 | I2 |
铜 | 746 | 1958 |
锌 | 906 | 1733 |
④写出Cu原子核外电子排布式;
⑤铜的第一电离能(I1)小于锌的第一电离能,而铜的第二电离能(I2)却大于锌的第二电离能,其主要原因是 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于14C的下列说法中不正确的是( )
A. 14C原子与C60中普通碳原子的化学性质相同
B. 14C原子与14N原子所含中子数不同
C. 是C60的同素异形体
D. 与12C、13C是碳元素的三种同位素
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com