
| A. | 分子式为C5H12O的醇,能在铜催化下被O2氧化为醛的同分异构体有5种 | |
| B. | 对苯二甲酸( )与乙二醇(HOCH2CH2OH)能通过加聚反应制取聚酯纤维( )与乙二醇(HOCH2CH2OH)能通过加聚反应制取聚酯纤维(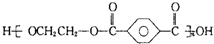 ) ) | |
| C. | 分子式为C9H10O2的有机物,①苯环上有两个取代基,②能与NaHCO3反应生成CO2气体,满足以上2个条件的该有机物的同分异构体有6种 | |
| D. | 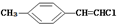 分子中的所有原子有可能共平面 分子中的所有原子有可能共平面 |
分析 A、分子式为C5H12O的醇,能在铜催化下被O2氧化为醛,则连接羟基的碳原子上含有2个氢原子,确定C5H12的同分异构体,-OH取代C5H12中甲基上的H原子,此确定醇的结构简式;
B、缩聚反应指生成高聚物同时有小分子物质生成;
C、该有机物能与NaHCO3发生反应产生CO2,说明含有羧基-COOH,苯环上有两个取代基,则取代基为-COOH、-CH2-CH3或-CH2COOH、-CH3,两个取代基有邻、间、对三种情况;
D、分子中含有甲基,具有甲烷的结构特点.
解答 A、分子式为C5H12O的醇,能在铜催化下被O2氧化为醛,则连接羟基的碳原子上含有2个氢原子,确定C5H12的同分异构体,-OH取代C5H12中甲基上的H原子,C5H12的同分异构体有:CH3CH2CH2CH2CH3、CH3CH(CH3)CH2CH3、(CH3)4C,
当烷烃为CH3CH2CH2CH2CH3,-OH取代甲基上的H原子有1种结构,
当烷烃为(CH3)2CHCH2CH3,-OH取代甲基上的H原子有2种结构,
当烷烃为(CH3)4C,-OH取代甲基上的H原子有1种结构,
C5H12O的同分异构体中可以氧化为醛的醇有4种,故A错误;
B、乙二醇(HO-CH2-CH2-OH)和对苯二甲酸(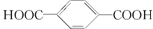 )生成聚酯纤维,同时还有水生成,为缩聚反应,故B错误;
)生成聚酯纤维,同时还有水生成,为缩聚反应,故B错误;
C、该有机物能与NaHCO3发生反应产生CO2,说明含有羧基-COOH,苯环上有两个取代基,则取代基为-COOH、-CH2-CH3或-CH2COOH、-CH3,两个取代基有邻、间、对三种情况,所以该有机物的同分异构体共有6种,故C正确;
D、甲烷是正四面体结构,分子中含有甲基,所有的原子不可能都在同一平面上,故D错误;
故选C.
点评 本题考查有机物的性质和同分异构体的书写,难度较大,注意能被氧化成醛必须是与羟基相连的碳原子上含有至少2个氢原子.


科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 重结晶对溶剂的要求是杂质在此溶剂中溶解度很小或很大 | |
| B. | 用重结晶法分离液态混合物时,温度越低越好 | |
| C. | 重结晶对溶剂的要求是被提纯的物质在此溶剂中的溶解度受温度的影响较大 | |
| D. | 重结晶过滤时趁热过滤并加入少量蒸馏水 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 和
和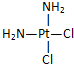 ,a具有抗癌作用而b没有,则两者互为( )
,a具有抗癌作用而b没有,则两者互为( )| A. | 同分异构体 | B. | 同素异形体 | C. | 同系物 | D. | 同种物质 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 可以用BaCl2溶液和稀硝酸检验Na2SO3是否变质 | |
| B. | 某溶液中滴入KSCN溶液后变红,说明溶液中存在Fe3+ | |
| C. | MnO2、CuO、Fe三种物质的粉末都是黑色的,用稀盐酸能将它们区别开 | |
| D. | 用湿润的KI淀粉试纸可以检验氯化氢气体中是否含有氯气 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②③ | B. | ①③④ | C. | ②④⑤ | D. | ②③⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
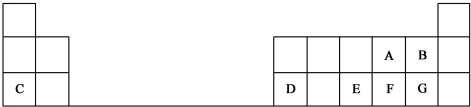
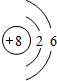 .D在元素周期表中的位置是第3周期ⅢA.
.D在元素周期表中的位置是第3周期ⅢA.查看答案和解析>>
科目:高中化学 来源: 题型:实验题
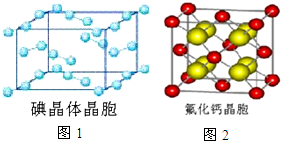 卤族元素的单质和化合物很多,我们可以利用所学物质结构与性质的相关知识去认识和理解它们.
卤族元素的单质和化合物很多,我们可以利用所学物质结构与性质的相关知识去认识和理解它们.| 氟 | 氯 | 溴 | 碘 | 铍 | |
| 第一电离能 (kJ/mol) | 1681 | 1251 | 1140 | 1008 | 900 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙烯的结构简式:CH2CH2 | B. | 次氯酸的结构式:H-O-Cl | ||
| C. | NH4Cl的电子式: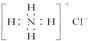 | D. | 硝基苯的结构简式: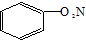 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com