
【题目】Ni2+与丁二酮肟生成鲜红色丁二酮肟镍沉淀,该反应可用于检验Ni2+。
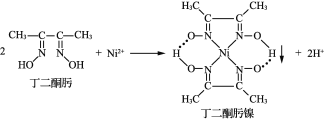
(1)Ni2+基态核外电子排布式为___________。
(2)1mol丁二酮肟分子中含有σ键的数目为______mol。
(3)丁二酮肟镍分子中碳原子的杂化轨道类型为_____。
(4)Ni(CO)4是一种无色液体,沸点为43℃,熔点为-19.3 ℃。Ni(CO)4的晶体类型是____。
(5)与CO互为等电子体的二价阴离子为_____,Ni(CO)4中Ni与CO的C原子形成配位键,不考虑空间构型,Ni(CO)4的结构可用示意图表示为_____。
(6)下列离子的VSEPR模型与离子的空间立体构型一致的是_______。
A.SO32- B.ClO4- C.NO2- D.ClO3-
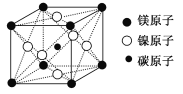
(7)最近发现,只含镁、镍和碳三种元素的晶体竟然也具有超导性。鉴于这三种元素都是常见元素,从而引起广泛关注。该新型超导晶体的一个晶胞如图所示,则该晶体的化学式为______
【答案】1s22s22p63s23p63d8或[Ar]3d8 15 sp2、sp3 分子晶体 C![]()
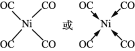 B MgCNi3
B MgCNi3
【解析】
(1)镍原子核外电子数是28,镍原子失去最外层2个电子变成基态Ni2+,根据构造原理书写基态Ni2+的核外电子排布式;
(2)单键中含有一个σ键,双键含有一个σ键和一个π键;
(3)根据价层电子对互斥理论确定中心原子杂化方式;
(4)分子晶体的熔沸点较低;
(5)价电子数相等、原子个数相等的微粒为等电子体;Ni(CO)4中Ni与CO的C原子形成配位键,形成四面体结构。
(6) 价层电子对互斥模型(简称VSEPR模型),根据价电子对互斥理论,价层电子对个数=σ键个数+孤电子对个数;σ键个数=配原子个数,孤电子对个数=![]() (a-xb),a指中心原子价电子个数,x指配原子个数,b指配原子形成稳定结构需要的电子个数;分子的立体构型是指分子中的原子在空间的排布,不包括中心原子未成键的孤对电子;实际空间构型要去掉孤电子对,略去孤电子对就是该分子的空间构型;
(a-xb),a指中心原子价电子个数,x指配原子个数,b指配原子形成稳定结构需要的电子个数;分子的立体构型是指分子中的原子在空间的排布,不包括中心原子未成键的孤对电子;实际空间构型要去掉孤电子对,略去孤电子对就是该分子的空间构型;
(7)利用均摊法确定晶胞的化学式,位于顶点上的一个原子被8个晶胞占有,位于面心上的原子被2个晶胞占有,位于体心上的一个原子被一个晶胞占有,据此计算晶胞的化学式。
(1)镍原子核外电子数是28,镍原子失去最外层2个电子变成基态Ni2+,根据构造原理知,基态Ni2+的核外电子排布式为1s22s22p63s23p63d8(或[Ar]3d8);
(2)已知丁二酮肟的结构式为![]() ,分子中含有13个单键,和2个双键,则共含有15个σ键,所以1mol丁二酮肟含有σ键数目为15mol;
,分子中含有13个单键,和2个双键,则共含有15个σ键,所以1mol丁二酮肟含有σ键数目为15mol;
(3)甲基上碳原子价层电子对个数是4且不含孤电子对,为sp3杂化,连接甲基的碳原子含有3个价层电子对且不含孤电子对,为sp2杂化;
(4)Ni(CO)4是一种无色液体,沸点为43℃,熔点为-19.3 ℃。可见Ni(CO)4的晶体熔沸点较低,因为分子晶体的熔沸点较低,所以该物质的晶体类型为分子晶体;
(5)价电子数相等,原子个数相等的微粒为等电子体,故与CO互为等电子体的二价阴离子为C22-,Ni(CO)4中Ni与CO的C原子形成配位键,形成四面体结构,其结构图为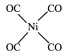 或
或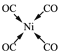 ;
;
(6)A.SO32-中价层电子对个数=3+![]() (6+2-3×2)=4且中心S原子上含有一个孤电子对,所以VSEPR模型为四面体结构,离子的空间立体构型为三角锥形结构,A错误;
(6+2-3×2)=4且中心S原子上含有一个孤电子对,所以VSEPR模型为四面体结构,离子的空间立体构型为三角锥形结构,A错误;
B.ClO4-中价层电子对个数=4+![]() (7+1-4×2)=4,且中心Cl原子且不含孤电子对,所以离子的VSEPR模型与离子的空间立体构型一致都是平面三角形结构,B正确;
(7+1-4×2)=4,且中心Cl原子且不含孤电子对,所以离子的VSEPR模型与离子的空间立体构型一致都是平面三角形结构,B正确;
C.NO2-中价层电子对个数=2+![]() ×(5+1-2×2)=3,且中心N原子上含有一个孤电子对,所以其VSEPR模型是平面三角形,实际上是V形,C错误;
×(5+1-2×2)=3,且中心N原子上含有一个孤电子对,所以其VSEPR模型是平面三角形,实际上是V形,C错误;
D.ClO3-中价层电子对个数=3+![]() ×(7+1-3×2)=4,且中心Cl原子上含有一个孤电子对,所以VSEPR模型是四面体结构,实际空间构型为三角锥形,D错误;
×(7+1-3×2)=4,且中心Cl原子上含有一个孤电子对,所以VSEPR模型是四面体结构,实际空间构型为三角锥形,D错误;
故合理选项是B。
(7)碳原子位于该晶胞的体心上,所以该晶胞中含有一个C原子;镁原子个数=8×![]() =1,则在该晶胞含有1个Mg原子;Ni原子个数=6×
=1,则在该晶胞含有1个Mg原子;Ni原子个数=6×![]() =3,在该晶胞中含有3个Ni原子,所以该晶胞的化学式为MgCNi3。
=3,在该晶胞中含有3个Ni原子,所以该晶胞的化学式为MgCNi3。


 优生乐园系列答案
优生乐园系列答案科目:高中化学 来源: 题型:
【题目】如图曲线a和b是可溶性一元强碱与盐酸互滴的滴定曲线,下列说法正确的是
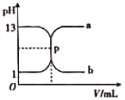
A.可溶性一元强碱、盐酸的物质的量浓度均为1mol·L-1
B.p点为滴定终点(两者恰好完全反应),溶液呈中性
C.酚酞不能用作该滴定的指示剂
D.曲线b是可溶性一元强碱滴定盐酸的滴定曲线
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图为某原电池装置:

(1)若A为铜,B为铁,电解质溶液为Fe2(SO4)3溶液,则铁片为______极(填“正”或“负”),A极电极反应式为_______,是_______(填“氧化反应”或“还原反应”)。
(2)若A为PbO2,B为Pb,电解质溶液为稀硫酸,放电时的方程式为:PbO2+Pb+2H2SO4=2PbSO4+2H2O,则B极的电极反应式为_________,H+向__________(填“正”或“负”)极移动。
(3)若A、B均为Pt电极,电解质溶液为稀硫酸,则向A极通入H2, B极通入O2,B极的反应为:O2+4e-+4H+=2H2O,则A极的电极反应式为_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A.等质量的甲烷、乙烯、1,3—丁二烯分别充分燃烧,所耗用氧气的量依次减少
B.按系统命名法,化合物![]() 的名称为2—甲基—4—乙基戊烷
的名称为2—甲基—4—乙基戊烷
C.苯酚、水杨酸( )和苯甲酸都是同系物
)和苯甲酸都是同系物
D.三硝基甲苯的分子式为C7H3N3O6
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有A、B、C、D、E五种元素。其相关信息如下:
元素 | 相关信息 |
A | A原子的1s轨道上只有1个电子 |
B | B是电负性最大的元素 |
C | C的基态原子2p轨道中有三个未成对电子 |
D | D是主族元素且与E同周期,其最外能层上有两个运动状态不同的电子 |
E | E能形成红色(或砖红色)的E2O和黑色的EO两种氧化物 |
请回答下列问题:
(1)写出E元素原子基态时的电子排布式_______。
(2)C元素的第一电离能比氧元素的第一电离能_____(填“大”或“小”)。
(3)CA3分子中C原子的杂化轨道类型是______,CA3分子的空间构型是_____。
(5)A、C、E三种元素可形成[E(CA3)4]2+配离子,其中存在的化学键类型有________(填序号)。
①配位键 ②金属键 ③极性共价键 ④非极性共价键 ⑤离子键 ⑥氢键
(5)B与D可形成离子化合物,其晶胞结构如图所示。其中D离子的配位数为_______。
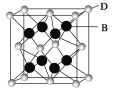
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表为元素周期表的一部分,其中的编号代表对应的元素。
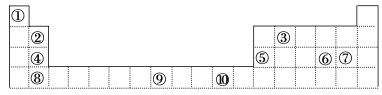
请回答下列问题:
(1)表中属于d区的元素是___(填编号)。④⑤⑥⑦⑧五种元素形成的稳定离子中,离子半径是小的是_____(填离子称号)
(2)表中元素①的6个原子与元素③的6个原子形成的某种环状分子构型为_____。
(3)某元素的特征电子排布式为nsnnpn+1,该元素原子的最外层电子的孤电子对数为_____。该原子的第一电离能______电子排布式为nsnnpn+2的原子(填“大于”、“等于”或“小于”)。
(4)某些不同族元素的性质也有一定的相似性,如上表中元素⑤与元素②的氢氧化物有相似的性质。请写出元素②的氢氧化物与NaOH溶液反应的化学方程式:________。
(5)上述10种元素形成的最高价氧化物对应水化物中,酸性最强的是________(填化学式)
(6)下列各组微粒的空间构型相同的是_________
①NH3和H2O ②NH4+和H3O+ ③NH3和H3O+ ④O3和SO2 ⑤CO2和BeCl2 ⑥SiO44-、ClO4-和SO42-⑦BF3和Al2Cl6
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】雾霾严重影响人们的生活与健康。某地区的雾霾中可能含有如下可溶性无机离子:Na+、NH4+、Mg2+、Al3+、SO42-、NO3-、Cl- 。某同学收集了该地区的雾霾,经必要的预处理后试样溶液,设计并完成了如下的实验:
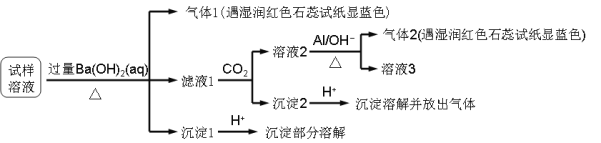
已知:3NO3-+ 8Al + 5OH- + 2H2O![]() 3NH3 + 8AlO2-
3NH3 + 8AlO2-
根据以上的实验操作与现象,该同学得出的结论不正确的是
试样中肯定存在NH4+、Mg2+、SO42-和NO3-
试样中一定不含Al3+
试样中可能存在Na+、Cl-
该雾霾中可能存在NaNO3 、NH4Cl和MgSO4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】四氯化锡可用作媒染剂。利用如图所示装置可以制备四氯化锡(部分夹持装置略去)。
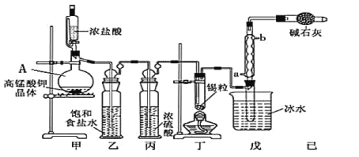
有关信息如下表

回答下列问题:
(1)甲装置中仪器A的名称为_________。
(2)用甲装置制氯气,MnO4-被还原为Mn2+,该反应的离子方程式为_____________。
(3)将装置如图连接好,检查气密性,慢慢滴入浓盐酸,待观察到______(填现象)后,开始加热丁装置,锡熔化后适当增大氯气流量,继续加热丁装置,此时继续加热丁装置的目的是: ①促进氯气与锡反应; ②_________。
(4)乙装置的作用 __________,如果缺少乙装置,可能发生的副反应的化学方程式为___________;己装置的作用是__________(填序号)
A.防止空气中CO2气体进入戊装置
B.除去未反应的氯气,防止污染空气
C.防止水蒸气进入戊装置的试管中使产物水解
D.防止空气中O2进入戊装置的试管中使产物氧化
(5)反应中用去锡粒1.19g,反应后在戊装置的试管中收集到2.04g SnCl4,则SnCl4的产率为________。(保留2位有效数字)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关同系物、同分异构体的说法正确的是( )
A.分子组成相差一个或多个CH2原子团的物质互为同系物
B.结构不同,式量相同的物质一定是同分异构体
C.同系物的化学性质相似,同分异构体的化学性质一定不相似
D.正丁烷一氯代物的同分异构体有2种,二氯代物的同分异构体有6种
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com