
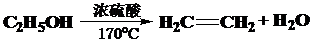 .
.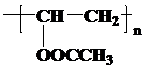 .
.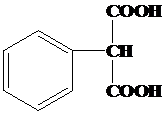 .
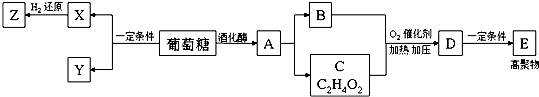
. 分析 葡萄糖在酒化酶的作用下生成有机物A,A为CH3CH2OH,B是石油化学工业最重要的基础原料,则B为CH2=CH2,A发生消去反应生成B,根据C的分子式可知,A氧化得C为CH3COOH,B和C发生信息中的反应生成D为CH3COOCH=CH2,D发生加聚反应得E为 ,葡萄糖在一定条件下可氧化为X和Y,X的相对分子质量介于A、B之间,Y的相对分子质量与A相同,X可催化氧化成Y,则X为HCHO,Y为HCOOH,X可与H2反应生成Z,则Z为CH3OH,据此分析解答.
,葡萄糖在一定条件下可氧化为X和Y,X的相对分子质量介于A、B之间,Y的相对分子质量与A相同,X可催化氧化成Y,则X为HCHO,Y为HCOOH,X可与H2反应生成Z,则Z为CH3OH,据此分析解答.
解答 解:葡萄糖在酒化酶的作用下生成有机物A,A为CH3CH2OH,B是石油化学工业最重要的基础原料,则B为CH2=CH2,A发生消去反应生成B,根据C的分子式可知,A氧化得C为CH3COOH,B和C发生信息中的反应生成D为CH3COOCH=CH2,D发生加聚反应得E为 ,葡萄糖在一定条件下可氧化为X和Y,X的相对分子质量介于A、B之间,Y的相对分子质量与A相同,X可催化氧化成Y,则X为HCHO,Y为HCOOH,X可与H2反应生成Z,则Z为CH3OH,
,葡萄糖在一定条件下可氧化为X和Y,X的相对分子质量介于A、B之间,Y的相对分子质量与A相同,X可催化氧化成Y,则X为HCHO,Y为HCOOH,X可与H2反应生成Z,则Z为CH3OH,
(1)①D为CH3COOCH=CH2,该分子中官能团名称是酯基和碳碳双键,故答案为:酯基、碳碳双键;
②A为CH3CH2OH,B为CH2=CH2,A发生消去反应生成B,反应方程式为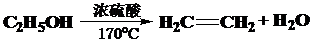 ,
,
故答案为: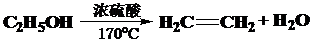 ;
;
③通过以上分析知,E结构简式为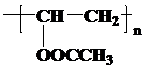 ,故答案为:
,故答案为: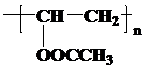 ;
;
(2)①A.X为HCHO,室温下,HCHO为气体,故A正确;
B.上述化合物中,有葡萄糖和HCHO及HCOOH都可以发生银镜反应,故B错误;
C.A为CH3CH2OH,Y为HCOOH,它们不是同分异构体,故C错误;
D.A为CH3CH2OH,Z为CH3OH,都具有相同官能团羟基,属于同系物,故D正确;
故答案为:AD;
②与葡萄糖相对分子质量相同的芳香族化合物N,即相对分子质量为180,它的苯环上只有一个取代基,1mol N与足量NaHCO3反应,生成44.8L CO2(标准状况)即2mol,所以每个N中有两个羧基,则N的结构简式为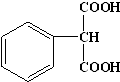 ,故答案为:
,故答案为: .
.
点评 本题考查有机物推断,为高频考点,侧重考查学生分析推断能力,明确官能团及其性质关系是解本题关键,注意结合反应条件及题给信息进行推断,题目难度不大.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
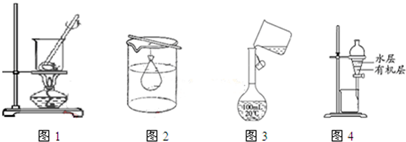
| A. | 图1:实验室灼烧胆矾测定胆矾中结晶水的含量 | |
| B. | 图2:除去Fe(OH)3胶体中的FeCl3 | |
| C. | 图3:向容量瓶中转移液体 | |
| D. | 图4:用苯萃取溴水中的Br2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 微粒半径由小到大的顺序是S2-、Na+、Mg2+ | |
| B. | 杂化轨道可用于形成σ键和π键 | |
| C. | Cu(NH3)4]2+中H提供接受孤对电子的空轨道 | |
| D. | 分子中心原子通过sp3杂化轨道成键时,该分子不一定为四面体构型 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com