

| A. | 金刚石转变为石墨是吸热反应 | |
| B. | S(g)+O2(g)═SO2(g)△H1,S(s)+O2(g)═SO2(g)△H2,则△H1>△H2 | |
| C. | 白磷比红磷稳定 | |
| D. | CO(g)+H2O(g)═CO2(g)+H2(g)△H<0 |
分析 A、图象分析金刚石能量高于石墨;
B、依据图象分析固体硫变化为气态硫需要吸收能量;
C、图象分析白磷能量高于红磷;
D、图象分析反应物CO(g)+H2O(g)的能量总和高于生成物CO2(g)+H2(g)的能量总和.
解答 解:A、图象分析金刚石能量高于石墨,石墨转变为金刚石是吸热反应,故A错误;
B、依据图象分析固体硫变化为气态硫需要吸收能量,相同条件下,等质量S(g)和S(s)的能量比较,S(s)较小,故B错误;
C、图象分析白磷能量高于红磷,能量越高越活泼,白磷比红磷活泼,故C错误;
D、图象分析反应物CO(g)+H2O(g)的能量总和高于生成物CO2(g)+H2(g)的能量总和,反应是放热反应,故D正确,
故选D.
点评 本题主要考查了图象分析判断,熟练掌握焓变和物质能量的变化分析判断是关键,题目较简单.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:选择题
| A. | 向明矾溶液中滴加Ba(OH)2溶液,恰好使SO42-沉淀完全:3Ba2++3SO42-+2Al3++6OH-═2BaSO4↓+2Al(OH)3↓ | |
| B. | 醋酸除去水垢:CaCO3+2H+═Ca2++CO2↑+H2O | |
| C. | 碳酸氢钠和偏铝酸钠反应:HCO3-+AlO2-+H2O═CO32-+Al(OH)3↓ | |
| D. | 向硫酸铜中加入过量氨水:Cu2++2NH3•H2O═Cu(OH)2↓+2NH4+ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 溶液中一定含Cu2+ | B. | 溶液中不一定含Fe2+ | ||
| C. | 剩余固体一定含Cu和Fe | D. | 加入KSCN溶液一定不变红色 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 22.1 g | B. | 27.2 g | C. | 30 g | D. | 14.6 g |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Y的低价氧化物能使Z单质的水溶液褪色 | |
| B. | X的氢化物溶于水显酸性 | |
| C. | 其离子半径大小:Z>Y>X | |
| D. | X的氢化物和Z的最高价氧化物对应的水化物不能反应生成盐 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 铁粉溶解,没有任何金属生成 | B. | 铁粉未完全溶解 | ||
| C. | 析出0.1mol 银和0.1mol 铜 | D. | 析出0.1mol 银和0.05mol 铜 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
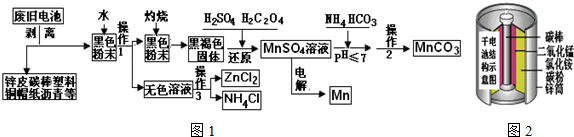
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Cl2+2NaOH═NaCl+NaClO+H2O | B. | Fe+CuSO4═FeSO4+Cu | ||
| C. | 2H2O$\frac{\underline{\;通电\;}}{\;}$2H2↑+O2↑ | D. | 2KClO3$\frac{\underline{MnO_2}}{△}$2KCl+3O2↑ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com