
科目:高中化学 来源: 题型:
依据氧化还原反应:2Ag+(aq)+Cu(s) Cu2+(aq)+2Ag(s),设计的原电池如图所示。下列有关说法中错误的是 ( )
Cu2+(aq)+2Ag(s),设计的原电池如图所示。下列有关说法中错误的是 ( )
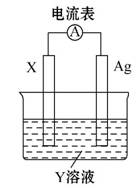
A.电解质溶液Y是CuSO4溶液
B.电极X的材料是Cu
C.银电极为电池的正极,其电极反应为Ag++e-====Ag
D.外电路中的电子是从X电极流向Ag电极
查看答案和解析>>
科目:高中化学 来源: 题型:
关于过氧化物的叙述正确的是(NA表示阿伏伽德罗常数)( )
A.7.8g过氧化钠含有的共用电子对数为0.2NA
B.2H2O2(l)=2H2O(l)+O2(g) ΔH=−98.2 kJ·mol−1,ΔS=70.5 J·mol−1·K−1,该反应低温能自发进行
C.过氧化氢使高锰酸钾溶液褪色,1mol过氧化氢得到2NA电子
D.在含有NH4+、Ba2+、Cl—、NO3—离子的溶液 加入少量过氧化钠以上各离子量几乎不减少
查看答案和解析>>
科目:高中化学 来源: 题型:
如图所示为800 ℃时A、B、C三种气体在密闭容器中反应时浓度的变化,只从图上分析不能得出的结论是( )
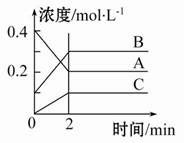
A.发生的反应可表示为:2A(g) 2B(g)+C(g)
2B(g)+C(g)
B.前2 min A的分解速率为0.1mol·L-1·min-1
C.开始时,正逆反应同时开始
D.2 min时,A、B、C的浓度之比为2∶3∶1
查看答案和解析>>
科目:高中化学 来源: 题型:
某探究小组用测量HNO3与大理石反应过程中质量减小的方法,研究影响反应速率的因素。限选试剂: 1.00 mol·L-1 HNO3、2.00 mol·L-1
HNO3,细颗粒大理石、粗颗粒大理石,35 ℃水浴。
(1)他们能完成哪些因素对速率影响的探究?
__________________________________________________________________。
(2)请根据能进行的探究内容,填写以下实验设计表,完成探究实验:
| 实验编号 | T/℃ | 大理石规格 | HNO3浓度/mol·L-1 |
| ① | 常温 | 2.00 | |
| ② | 1.00 | ||
| ③ | 2.00 | ||
| ④ | 2.00 |
(3)整个实验中应控制的不变量是硝酸溶液体积和________。
(4)该实验小组用如图实验装置进行实验。

①除电子天平、干燥管、锥形瓶、药匙、胶塞等仪器外,必需的实验仪器还有__________。
②干燥管中应放置的试剂是______。
A.碱石灰 B.无水CaCl2
C.P2O5固体 D.浓硫酸
③若撤除干燥管装置,所测速率________(填“偏大”“偏小”或“不变”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
已知 现将体积比为
现将体积比为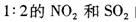 的混合气体置于密闭容器中发生上述反应,下列说明反应达到平衡状态的是
的混合气体置于密闭容器中发生上述反应,下列说明反应达到平衡状态的是
A. 体系压强保持不变 B. 混合气体颜色保持不变
C. 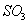 与
与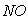 的体积保持不变 D.每消耗1mol
的体积保持不变 D.每消耗1mol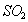 同时生成1mol
同时生成1mol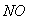
查看答案和解析>>
科目:高中化学 来源: 题型:
(1)将 (某一元酸)溶液与
(某一元酸)溶液与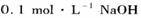 溶液等体积混合,测得混合溶液中
溶液等体积混合,测得混合溶液中 ,则此溶液中
,则此溶液中 ;
; 此溶液中由水电离出的
此溶液中由水电离出的
 溶液中由水电离出的
溶液中由水电离出的 (填“>”、“<”或“=”)。
(填“>”、“<”或“=”)。
(2)将等体积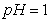 的盐酸和醋酸,加入适量水,
的盐酸和醋酸,加入适量水, 都升高了1,则加水后溶液体积V(醋酸)____V(盐酸)(填“>”、“<”或“=”)。
都升高了1,则加水后溶液体积V(醋酸)____V(盐酸)(填“>”、“<”或“=”)。
(3)常温下,某酸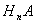 (A为酸根)与某碱
(A为酸根)与某碱 溶液恰好完全反应生成正盐,该溶液
溶液恰好完全反应生成正盐,该溶液 。写出该正盐的化学式____,该盐中____离子一定能水解,其水解离子方程式为_______。
。写出该正盐的化学式____,该盐中____离子一定能水解,其水解离子方程式为_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法正确的是
A.镧镍合金能大量吸收H2形成金属氢化物,可作储氢材料
B.石英玻璃、陶瓷都属于硅酸盐产品
C.做衣服的棉、麻、蚕丝的成分都是纤维素
D.牛油和花生油在碱性条件下水解产物相同
查看答案和解析>>
科目:高中化学 来源: 题型:
化学反应N2+3H2
 2NH3的能量变化如下图所示,该反应的热化学方程式是( )
2NH3的能量变化如下图所示,该反应的热化学方程式是( )
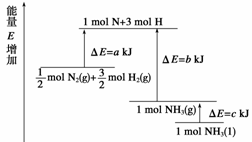
A.N2(g)+3H2(g)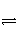
 2NH3(l) ΔH=2(a-b-c) kJ·mol-1
2NH3(l) ΔH=2(a-b-c) kJ·mol-1
B.N2(g)+3H2(g)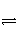
 2NH3(g) ΔH=2(b-a) kJ·mol-1
2NH3(g) ΔH=2(b-a) kJ·mol-1
C.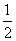 N2(g)+
N2(g)+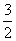 H2(g)
H2(g)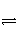
 NH3(l) ΔH=(b+c-a) kJ·mol-1
NH3(l) ΔH=(b+c-a) kJ·mol-1
D.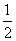 N2(g)+
N2(g)+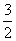 H2(g)
H2(g)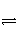
 NH3(g) ΔH=(a+b) kJ·mol-1
NH3(g) ΔH=(a+b) kJ·mol-1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com