
| 滴定次数 | 1 | 2 | 3 | 4 |
| 消耗酸性KMnO4溶液的体积/mL | 19.10 | 20.02 | 19.98 | 20.00 |
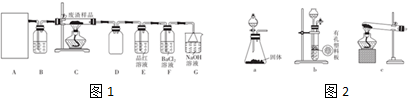
分析 (1)A中是用来制备氧气,B中盛放浓硫酸干燥氧气,C中硫化亚铜与氧气反应,D中进气管短,应是安全瓶,防止溶液倒吸,E装置检验二氧化硫,F中氧气与亚硫酸反应生成硫酸,硫酸与氯化钡溶液反应,最后需要尾气处理,防止二氧化硫污染空气,
①实验室制备氧气的装置可以依据固体和固体加热反应生成,选择装置,也可以选择液体和固体不加热反应生成选择装置;
②证明废渣中含有硫元素的实验现象是验证废渣灼烧生成的气体中含二氧化硫,可以利用装置E中品红溶液检验;
③氧气与亚硫酸反应生成硫酸,硫酸与氯化钡溶液反应;
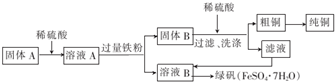
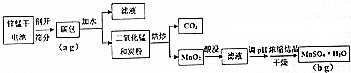
(2)固体A是CuO和Fe2O3,固体A和稀硫酸混合,发生的反应为CuO+H2SO4=CuSO4+H2O、Fe2O3+3H2SO4=Fe2(SO4)3+3H2O,所以溶液A中成分为CuSO4、Fe2(SO4)3,向溶液A中加入过量Fe屑,发生反应CuSO4+Fe=FeSO4+Cu、2Fe2(SO4)3+Fe=3FeSO4,所以固体B成分是Fe、Cu,滤液B成分为FeSO4,固体B和稀硫酸混合,Fe和稀硫酸反应生成FeSO4,Cu和稀硫酸不反应,过滤得到固体粗铜,硫酸亚铁溶液蒸发结晶得到绿矾;
①依据上述分析得到、固体B为铜和铁;
②由溶液B得到绿矾的过程是溶液中得到溶质晶体的过程为蒸发浓缩、冷却结晶、过滤洗涤、干燥得到;
③Ⅰ.第1组实验数据偏小,
a.量取绿矾溶液的酸式滴定管用蒸馏水洗净后未用标准液润洗,待测液浓度减小;
b.锥形瓶洗净后未干燥,溶质的物质的量未变;
c.滴定终点时俯视读数,读数在液面上方,滴定管刻度由上而下增大;
d.滴定前尖嘴有气泡,滴定后气泡消失,高锰酸钾溶液体积对数应大于实际消耗量;
Ⅱ.第2、3、4组数据平均值为消耗高锰酸钾溶液体积,根据方程式计算产品中绿矾的质量分数.
解答 解:(1)A中是用来制备氧气的装置,B中盛放浓硫酸干燥氧气,废弃固体主要成分Cu2S和Fe2O3,C中硫化亚铜与氧气反应,灼烧废气固体发生反应Cu2S+2O2$\frac{\underline{\;高温\;}}{\;}$SO2+2CuO,固体A是CuO和Fe2O3,D中进气管短,应是安全瓶,防止溶液倒吸,E装置检验二氧化硫,F中氧气与亚硫酸反应生成硫酸,硫酸与氯化钡溶液反应,最后需要尾气处理,防止二氧化硫污染空气,
①制备氧气的方法为二氧化锰和氯酸钾固体加热反应生成氧气可以选择装置c,也可以用过氧化氢滴入固体二氧化锰中发生反应生成氧气,可以选择装置a,
故答案为:ac;
②证明废渣中含有硫元素的实验现象是验证废渣灼烧生成的气体中含二氧化硫,利用装置E中品红溶液褪色证明含有硫元素,
故答案为:装置E中品红溶液褪色;
③氧气与亚硫酸反应生成硫酸,硫酸与氯化钡溶液反应,总的反应离子方程式为:2SO2+O2+2H2O+2Ba2+=2BaSO4↓+4H+,
故答案为:2SO2+O2+2H2O+2Ba2+=2BaSO4↓+4H+;
(2)固体A是CuO和Fe2O3,固体A和稀硫酸混合,发生的反应为CuO+H2SO4=CuSO4+H2O、Fe2O3+3H2SO4=Fe2(SO4)3+3H2O,所以溶液A中成分为CuSO4、Fe2(SO4)3,向溶液A中加入过量Fe屑,发生反应CuSO4+Fe=FeSO4+Cu、2Fe2(SO4)3+Fe=3FeSO4,所以固体B成分是Fe、Cu,滤液B成分为FeSO4,固体B和稀硫酸混合,Fe和稀硫酸反应生成FeSO4,Cu和稀硫酸不反应,过滤得到固体粗铜,硫酸亚铁溶液蒸发结晶得到绿矾;
①上述分析得到、固体B为铜和铁,
故答案为:Fe、Cu;
②由溶液B得到绿矾的过程是溶液中得到溶质晶体的过程为蒸发浓缩、冷却结晶、过滤洗涤、干燥得到,
故答案为:蒸发浓缩,过滤,干燥;
③Ⅰ.a.量取绿矾溶液的酸式滴定管用蒸馏水洗净后未用标准液润洗,待测液浓度减小,消耗酸性高锰酸钾溶液体积应偏小,测定浓度偏低,故a符合;
b.锥形瓶洗净后未干燥,溶质的物质的量未变,不影响高锰酸钾溶液体积,故b不符合;
c.滴定终点时俯视读数,读数在液面上方,滴定管刻度由上而下增大,则读数偏小,故c符合;
d.滴定前尖嘴有气泡,滴定后气泡消失,高锰酸钾溶液体积对数应大于实际消耗量,故d不符合,
故选:ac;
Ⅱ.消耗高锰酸钾溶液体积为$\frac{(20.2+19.98+20.00)ml}{3}$=20mL,
设产品中绿矾的质量分数为x,则:
10FeSO4+8H2SO4+2KMnO4═2MnSO4+5Fe2(SO4)3+K2SO4+8H2O
1520g 2mol
30g×$\frac{152}{152+126}$×x×$\frac{25ml}{250ml}$ 0.02L×0.1mol/L
所以1520g:30g×$\frac{152}{152+126}$×x×$\frac{25ml}{250ml}$=2mol:0.02L×0.1mol/L
解得x=92.7%,
故答案为:92.7%.
点评 本题是化学工艺流程与综合实验题目,涉及混合物的分离和提纯、对装置的分析与评价、物质含量测定等,侧重考查学生分析问题能力、实验操作能力,明确物质的性质是解本题关键,能从整体上分析各个步骤发生的反应,题目难度中等.


科目:高中化学 来源: 题型:实验题
| 酸的种类 | 浓度 | 锌的浸取率/% | 锰的浸取率/% |
| 硫酸 | 1:1 | 96.2 | 95.1 |
| 盐酸 | 1:1 | 95.1 | 94.6 |
| 硝酸 | 1:1 | 94.5 | 94.7 |
| 磷酸 | 1:1 | 58.4 | 42.3 |
| 浓度 | 锌的浸取率/% | 锰的浸取率/% |
| 1:1 | 96.2 | 95.1 |
| 1:2 | 90.4 | 88.5 |
| 1:3 | 87.3 | 82.4 |
| Mn(OH)2 | Al(OH)3 | |||||
| 开始沉淀 | 完全沉淀 | 开始沉淀 | 完全沉淀 | 开始溶解 | 完全溶解 | |
| PH | 8.2 | 9.8 | 3.7 | 5.2 | 7.8 | 10.0 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
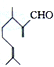 )是一种重要的香料,在硫酸的作用下能生成对异丙基甲苯(
)是一种重要的香料,在硫酸的作用下能生成对异丙基甲苯(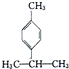 ).下列有关香叶醛与对异丙基甲苯的叙述正确的是( )
).下列有关香叶醛与对异丙基甲苯的叙述正确的是( )| A. | 对异丙基甲苯的分子式为C10H14 | |
| B. | 香叶醛的一种同分异构体可能是芳香醇 | |
| C. | 两者互为同分异构体 | |
| D. | 两者均能与溴水反应加成反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 简单离子的半径大小:Z>X>W | |
| B. | 最高价氧化物对应水化物的酸性:Y>Z | |
| C. | W分别与Y、Z形成的化合物均易溶于水 | |
| D. | X的单质既能和酸反应,又能和碱反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
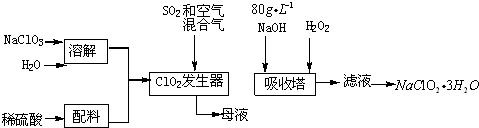
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | a c f h | B. | a c e g | C. | a c e f h | D. | b d e h |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | pH=3的醋酸与pH=11的氢氧化钠溶液等体积混合所得溶液的pH<7 | |
| B. | 反应2CO(g)+2H2(g)→CH3COOH (l)的△S>0 | |
| C. | 冰醋酸用水稀释,溶液中c(H+)先变大后变小 | |
| D. | 含有CH3COOH、C2H5OH、CH3COOC2H5及H2O的平衡体系中加入少量浓硫酸,CH3COOC2H5的物质的量不变 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com