
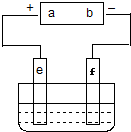
 ������ͼװ�ã���Ҫ��ش����⣮
������ͼװ�ã���Ҫ��ش����⣮���� ��1����װ��Ϊ���أ�aΪ������bΪ���������Դ����a������eΪ��������������������Ӧ�����Դ����b������fΪ����������������ԭ��Ӧ��
��2����⾫��ͭʱ������Ϊ��ͭ������Ϊ��ͭ��
��3����ʯī�缫�������ͭ��Һʱ��eΪ��������Һ������������������ʧ���ӷ���������Ӧ��
��4���������ͭ��Һʱ��ÿ����1molCuת��2mol���ӣ��ݴ˷�����
��� �⣺��1����װ��Ϊ���أ�aΪ������bΪ���������Դ����a������eΪ��������������������Ӧ�����Դ����b������fΪ����������������ԭ��Ӧ��
�ʴ�Ϊ����������ԭ��Ӧ��
��2����⾫��ͭʱ������Ϊ��ͭ������Ϊ��ͭ������e�缫���õIJ����Ǵ�ͭ���ʴ�Ϊ��A��
��3����ʯī�缫�������ͭ��Һʱ��eΪ��������Һ������������������ʧ���ӷ���������Ӧ���缫��ӦʽΪ4OH--4e-�TO2��+2H2O��
�ʴ�Ϊ��4OH--4e-�TO2��+2H2O��
��4���������ͭ��Һʱ��ÿ����1molCuת��2mol���ӣ���������������0.6molͭ���ڷ�Ӧ������ת�Ƶĵ�����Ŀ��1.2NA���ʴ�Ϊ��1.2��
���� ���⿼���˵����е缫�ж��Լ��缫��Ӧʽ��д�;ݵ缫��Ӧ�ļ��㣬��Ŀ�ѶȲ���


 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | 1 mol H2O����������Ϊ10NA | |
| B�� | �ڱ�״���£�0.5NA������������ռ�����Լ��11.2L | |
| C�� | ��״���£�22.4 L���������ķ�����ΪNA | |
| D�� | 1����������ԭ����ԼΪ6.02��1023 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | 2 Q2=Q1 | B�� | 2 Q2��Q1 | C�� | 2 Q2��Q1��Q | D�� | Q=Q1��Q2 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | 500 mL��Һ��Ba2+��Cl-����Ϊ0.3NA | |
| B�� | 500 mL��Һ��Ba2+Ũ��Ϊ0.2 mol•L-1 | |
| C�� | 500 mL��Һ��Cl-����Ϊ0.2 NA | |
| D�� | 500 mL��Һ��Cl-Ũ��Ϊ0.2 mol•L-1 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
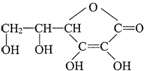 ά����C�Ľṹ��ʽ�ǣ����ķ���ʽ��C6H8O6���������ܷ��λ�Ѫ�����ֳ�Ϊ����Ѫ�ᣮ��ά����C��Һ�е�����ɫʯ����Һ����Һ��ɫ��죬˵��ά����C��Һ�������ԣ��г����۵�ij����Ƭ�к������Ŀ���ϸС�Ļ�ԭ���ۣ���Щ����������θ�ᣨ��Ҫ�ɷ�ʱ���ᣩ��������ת���������Σ����ӷ���ʽΪFe+2H+�TFe2++H2����
ά����C�Ľṹ��ʽ�ǣ����ķ���ʽ��C6H8O6���������ܷ��λ�Ѫ�����ֳ�Ϊ����Ѫ�ᣮ��ά����C��Һ�е�����ɫʯ����Һ����Һ��ɫ��죬˵��ά����C��Һ�������ԣ��г����۵�ij����Ƭ�к������Ŀ���ϸС�Ļ�ԭ���ۣ���Щ����������θ�ᣨ��Ҫ�ɷ�ʱ���ᣩ��������ת���������Σ����ӷ���ʽΪFe+2H+�TFe2++H2�����鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ��40g NaOH����1Lˮ�У�����NaOH��Һ��Ũ��Ϊ1mol•L-1 | |
| B�� | ��2.3g NaͶ�뵽97.7g�г�ַ�Ӧ��������Һ�����ʵ���������Ϊ4.0% | |
| C�� | ��t��ʱ����a g NH3��ȫ����ˮ���õ�V mL��Һ������Һ�����ʵ���Ũ��Ϊ$\frac{1000a}{17V}$mol•L-1 | |
| D�� | 1mol•L-1��������Һ��c��H+��=1mol•L-1 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | �ò���������©���е�Һ���Լӿ�����ٶ� | |
| B�� | ��Һʱ����Һ©���²�Һ����¿ڷų����ϲ�Һ����Ͽڵ��� | |
| C�� | ����е�NaOH��Һ�еμӱ����Ȼ�����Һ������ȡFe��OH��3���� | |
| D�� | ����ʱ����������Ͽڽ�ˮ���¿ڳ�ˮ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com