
【题目】臭氧层是地球生命的保护神,臭氧比氧气具有更强的氧化性。实验室可将氧气通过高压放电管来制取臭氧:3O2![]() 2O3。
2O3。
(1)若在上述反应中有30%的氧气转化为臭氧,所得混合气的平均摩尔质量为_______ g·mol-1(保留一位小数)。
(2)将8 L氧气通过放电管后,恢复到原状况,得到气体6.5 L,其中臭氧为________ L。
(3)在臭氧发生装置中装入氧气100 mL,经反应最后气体体积变为95 mL(体积均在标准状况下测定),则混合气体的密度是____________g·L-1(保留一位小数)
(4)实验室将氧气和臭氧的混合气体0.896 L(标准状况),通入盛有20.0 g铜粉的反应容器中,充分加热后,粉末的质量最终变为21.6 g。则原混合气中臭氧的体积分数______
【答案】35.6 3 1.5 50%
【解析】
(1)首先列三段式,再利用平均摩尔质量等于气体的总质量与总物质的量之比分析解答;
(2)利用差量法根据化学方程式列比例式解题;
(3)根据质量守恒定律可知,反应后混合气体的质量等于反应前氧气的质量,计算出反应前氧气的物质的量,再计算反应前氧气的质量,再根据![]() 计算混合气体的密度;
计算混合气体的密度;
(4)再根据n(混合气体)=![]() ,再利用氧原子守恒混合气体中含有的氧原子等于增加的质量中氧原子的数目解题。
,再利用氧原子守恒混合气体中含有的氧原子等于增加的质量中氧原子的数目解题。
(1)假设有1molO2,则可列出三段式:
3O2![]() 2O3
2O3
起始 1mol 0
反应 0.3mol 0.2mol
剩余 0.7mol 0.2mol
则反应后所得气体为0.2molO3和0.7molO2,共0.9mol,反应前后气体总质量不变,混合气体的总质量为m=1mol×32g/mol=32g,则所得混合气的平均摩尔质量为![]() ;
;
故答案为:35.6;
(2)此题可根据差量法计算,设生成臭氧的体积为X,则:
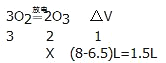
列方程式得![]() ,X=3L;
,X=3L;
故答案为:3;
(3)反应前氧气的物质的量为![]() ,故反应前氧气的质量为
,故反应前氧气的质量为![]() ,根据质量守恒定律可知,反应后混合气体的质量等于反应前氧气的质量,故反应后混合气体的密度为,
,根据质量守恒定律可知,反应后混合气体的质量等于反应前氧气的质量,故反应后混合气体的密度为,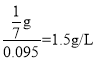
故答案为:1.5;
(4)![]() ,设臭氧的体积分数为a,根据氧原子守恒
,设臭氧的体积分数为a,根据氧原子守恒
0.04mol×a×3+0.04mol×(1-a)×2=![]()
解得a=50%;
故答案为:50%。


科目:高中化学 来源: 题型:
【题目】(化学–选修3:物质结构与性质)碳、氧、氮、镁、铬、铁、铜是几种重要的元素,请回答下列问题:
(1)在第二周期的元素中,第一电离能介于B与N之间的元素有_________种。
(2)查阅相关资料发现MgO的熔点比CuO的熔点高得多,其原因是_____________。
(3)Fe与CO能形成一种重要的催化剂Fe(CO)5,该分子中σ键与π键个数比为______________。请写出一个与CO互为等电子体的离子:________________。

(4)金属铬是一种银白色,极硬,耐腐蚀的金属,铬的化合物种类繁多,如:Gr2(SO4)3、K2Cr2O7以及配离子[Cr(H2O)3(NH3)3]3+。
①K2Cr2O7具有很强的氧化性,能直接将CH3CH2OH氧化成CH3COOH,试写出基态铬原子的价层电子排布式__________;CH3COOH分子中碳原子的杂化类型为___________。
②该配离子[Cr(H2O)3(NH3)3]3+中,中心离子的配位数为_______,NH3的VSEPR模型为_______。
③铜铬合金的晶胞如图所示,已知晶胞中Cr和Cu原子间的最近距离为![]() apm,则该晶体的密度为_______g·cm-3(用含a的代数式表示,设NA为阿伏加德罗常数的值)。
apm,则该晶体的密度为_______g·cm-3(用含a的代数式表示,设NA为阿伏加德罗常数的值)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】废旧铅蓄电池的回收利用可减少对环境的污染和实现铅资源的可持续发展,其阴、阳极填充物(铅膏,主要含PbO2、PbO、PbSO4)是废旧铅蓄电池的主要部分,回收铅单质的一种工艺流程如下:

(1)反应①的化学方程式为________________,操作a的名称是___________。
(2)滤液B中的溶质除Na2SO4外,还含有较多的___________(写化学式),若利用该滤液回收Na2SO4·10H2O,可加入___________(写试剂名称)除掉该物质。
(3)若反应②完成后的溶液中c(Pb2+)=5×10-6mol/L,则该溶液中c(SO42-)<___________ mol/L [已知Ksp(PbSO4)=1.06×10-8,Ksp (PbCO3)=3.3×10-14]
(4)用涂PbO2的钛板作阳极,铅板作阴极,电解含Pb2+的电解液,可得到纯度99.99%的Pb粉,产物Pb在___________极(填“阴”或“阳”)产生,阳极的电极反应式为___________。
(5)若实验中所取铅膏的质量为16g(PbO2的质量分数为15%),要将PbO2全部还原,至少需要加入1.0mol/L的Na2SO3溶液___________ mL(结果保留整数)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、W四种短周期元素在周期表中的位置如下图所示,Y2+与W-的电子数之差为8。下列说法正确的是

A. 原子半径大小:X>Y
B. 最高价氧化物对应水化物的酸性:Z>W
C. 工业上通过电解Y的氧化物制取Y单质
D. X与W可形成正四面体结构的有机物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A.标况下,11.2 L甲烷(CH4)和乙烯(C2H4)的混合气体中含氢原子的物质的量为2 mol
B.标况下,0.1 mol CCl4所占的体积为2.24 L
C.等质量的N2和CO含有的分子数均约为6.02×1023个
D.常温常压下,1 mol任何气体所占的体积均为22.4 L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)已知在一定条件下发生反应:A+B=C+D,14gA和9gB恰好完全反应生成0.5molC和1gD则物质C的摩尔质量为____________;
(2)某1L混合溶液中所含离子的个数比如下表,则M离子可能为(_______)
所含离子 | NO3- | SO42- | Cu2+ | M |
个数比 | 4 | 1 | 2 | 1 |
A.Ba2+ B.Mg2+ C.Cl- D.Na+
(3)已知a g气体X2中含有b个X原子,那么c g该气体在标准状况下的体积是____________;
(4)把V L含有MgSO4与K2SO4的混合溶液分成两等份,一份加入含a mol NaOH的溶液,恰好使镁离子完全沉淀为Mg(OH)2;另一份加入含b mol BaCl2的溶液,恰好使SO![]() 完全沉淀为BaSO4,则原混合溶液中钾离子的物质的量浓度为________。
完全沉淀为BaSO4,则原混合溶液中钾离子的物质的量浓度为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知723K时,2SO2(g)+O2(g)![]() 2SO3(g)△H=﹣QkJ/mol,在相同条件下,向一密闭容器中通入2mol SO2和1mol O2,达到平衡时放出的热量为Q1kJ;向另一体积相同的密闭容器中通入1mol SO2和0.5mol O2,达到平衡时放出的热量为Q2kJ。则Q1、Q2、Q满足的关系是( )
2SO3(g)△H=﹣QkJ/mol,在相同条件下,向一密闭容器中通入2mol SO2和1mol O2,达到平衡时放出的热量为Q1kJ;向另一体积相同的密闭容器中通入1mol SO2和0.5mol O2,达到平衡时放出的热量为Q2kJ。则Q1、Q2、Q满足的关系是( )
A.Q2=![]() B.Q2>
B.Q2>![]() C.Q2<Q1<Q D.Q=Q1>Q2
C.Q2<Q1<Q D.Q=Q1>Q2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于化学电源的叙述,错误的是( )
A. 化学电源均是根据原电池的工作原理设计的
B. 在干电池中,碳棒只起导电作用,并不参加化学反应
C. 镍镉电池不能随意丢弃的原因是镍、镉的资源有限,价格昂贵
D. 燃料电池是一种高效、环保的新型化学电源
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com