
| A��ϡHCl��ϡNaOH |
| B��1.0 mol��L-1 HCl��1.0 mol��L �C1 NaOH |
| C��500 mL 2.0 mol��L-1 HCl��500 mL2.0 mol��L �C1 NaOH |
| D��500 mL 2.0 mol��L-1 H2SO4��500 mL 2.0 mol��L-1 Ba(OH)2 |


 ��ѧ�����ϵ�д�
��ѧ�����ϵ�д� �·Ƿ��̸����100��ϵ�д�
�·Ƿ��̸����100��ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
 ZnSO4 + H2 �Ļ�ѧ��Ӧ(��Ӧ����),��������һ����ȷ����
ZnSO4 + H2 �Ļ�ѧ��Ӧ(��Ӧ����),��������һ����ȷ����
| A��1 mol���������1 mol H2���������� |
| B�������÷�Ӧ��Ƴ�ԭ���,пΪ���� |
| C�����������Ϊԭ���,����32.5 gп�ܽ�ʱ,�����ų�����һ��Ϊ11.2 L |
D����Ӧ������������ϵ������ͼ��ʾ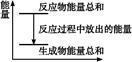 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ�ʵ����

| A�������Ũ�� |
| B��������¶� |
| C������������Һ��Ũ�� |
| D������������Һ���¶� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
 ������˵������ȷ����
������˵������ȷ����| A���÷�Ӧ���ر䡢�ʱ�Դ���0 |
| B���÷�Ӧ�����ȷ�Ӧ�����һ�������Է����� |
| C��̼���ηֽⷴӦ�������ӣ�����κ�����������̼���ηֽ�һ���Է����� |
| D�����Է����еķ�Ӧһ���Ƿ��ȷ�Ӧ�������Է����еķ�Ӧһ�������ȷ�Ӧ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ������
| ���� | F2 | Cl2 | Br2 | I2 | H2 | HF | HCl | HBr | HI |
| ����(kJ) | 157 | 243 | 194 | 153 | 436 | 568 | 432 | 366 | 299 |

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��

| A���÷�ӦΪ���ȷ�Ӧ |
| B���÷�ӦΪ���ȷ�Ӧ |
| C����Ӧ�������������������������� |
| D���÷�Ӧֻ���ڼ��������²��ܽ��� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ�ʵ����
| ʵ �� �� Ʒ | �� Һ �� �� | �к��� ��H | |||
| t1 | t2 | ||||
| �� | 50mL 0.55mol.L-1NaOH | 50mL 0.5mol.L-1HCl | 20�� | 23.3�� | |
| �� | 50mL 0.55mol.L-1NaOH | 50mL 0.5mol.L-1HCl | 20�� | 23.5�� | |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| A��Q1��Q2=Q3 | B��Q2>Q1>Q3 | C��Q2>Q3>Q1 | D��Q2=Q3>Q1 |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com