
| A. | 新制氯水中只含Cl2和H2O分子 | |
| B. | 新制氯水不能使干燥的有色布条褪色 | |
| C. | 光照氯水有气泡逸出,该气体是Cl2 | |
| D. | 新制氯水可使蓝色石蕊试纸先变红后褪色 |
分析 氯水中,氯气与水发生:Cl2+H2O?HClO+HCl,溶液中含有Cl2、HClO、H2O等分子,含有H+、ClO-、Cl-等离子,氯水具有酸性和强氧化性,其中HClO见光易分解而变质,以此解答.
解答 解:A、新制氯水中含有Cl2、HClO、H2O,故A错误;
B、新制氯水中含有HClO,具有强氧化性,能使干燥的有色布条褪色,故B错误;
C、氯水中含有HClO,不稳定,见光易分解生成氧气,该气体是O2,故C错误;
D、新制氯水显酸性,其中含有HClO,可使蓝色石蕊试纸先变红后褪色,故D正确;
故选D.
点评 本题综合考查氯气和氯水的性质,注意把握氯气和水反应的特点以及氯水的成分和性质,为高考高频考点,侧重于基础知识的综合运用,难度不大.


科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
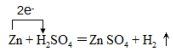 或
或 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 该氖原子的相对原子质量是12$\frac{a}{b}$ | B. | 该氖原子的摩尔质量是aNAg | ||
| C. | Wg该氖原子的物质的量是$\frac{W}{{a{N_A}}}$mol | D. | Wg该氖原子所含质子数是10W/a |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
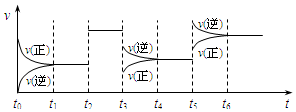 某密闭容器中发生如下反应:X(g)+3Y(g)?2Z(g);△H<0,如图表示该反应的速率(v)随时间(t)变化的关系,t2、t3、t5时刻外界条件有所改变,但都没有改变各物质的初始加入量.下列说法中正确的是
某密闭容器中发生如下反应:X(g)+3Y(g)?2Z(g);△H<0,如图表示该反应的速率(v)随时间(t)变化的关系,t2、t3、t5时刻外界条件有所改变,但都没有改变各物质的初始加入量.下列说法中正确的是| A. | t2时加入了催化剂 | B. | t3时降低了温度 | ||
| C. | t5时升高了温度 | D. | t4~t5时间内转化率一定最低 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | b>c>a | B. | b>a>c | C. | c>b>a | D. | a>b>c |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com