
 快乐5加2金卷系列答案
快乐5加2金卷系列答案科目:高中化学 来源: 题型:
铬及其化合物应用广泛。例如用经硫酸酸化处理的三氧化铬(CrO3)硅胶测试司机呼出的气体,根据硅胶颜色的变化可以判断司机是否酒驾
(1)基态铬原子的电子排布式为 。
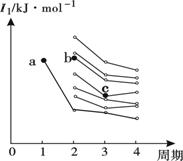
(2)右图是部分主族元素第一电离能梯度图,图中,a点对应的元素为氢,b、c两点对应的元素分别为 、 (填元素符号)。
(3)测试过程中,乙醇被氧化为乙醛(CH3CHO)。乙醇与乙醛
的相对分子质量相差不大,但乙醇的沸点(78.5℃)却比乙醛的沸点(20.8℃)高出许多,其原因是 。
(4)氯化铬酰(CrO2Cl2)可用作染料溶剂,熔点为-96.5℃,沸点为117℃,能与四氯化碳等有机溶剂互溶。氯化铬酰晶体属于 (填晶体类型)。
(5)将CrCl3·6H2O溶解在适量水中得到深绿色溶液,溶液中Cr3+以[Cr(H2O)5Cl]2+ 形式存在。
①上述溶液中,不存在的微粒间作用力是 (填标号)。
A.离子键 B.共价键 C.金属键D.配位键 E.范德华力
②[Cr(H2O)5Cl]2+中Cr3+的轨道杂化方式不是sp3,理由是 。
(6)在酸性溶液中,H2O2能与重铬酸盐作用生成蓝色的CrO5,离子方程式为:
4H2O2 + 2H+ + Cr2O72- =2CrO5 + 5H2O根据下图所示Cr2O72-和CrO5的结构判断,上述反应 (填“是”或“不是”)氧化还原反应。
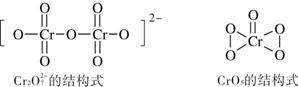
查看答案和解析>>
科目:高中化学 来源: 题型:
36.5 g HCl溶解在1 L水中(水的密度近似为l g/cm3),所得溶液的密度为ρg/cm3,质量分数为ω,物质的量浓度为c mol/L,NA表示阿伏加德罗常数,则下列叙述中正确的是
L水中(水的密度近似为l g/cm3),所得溶液的密度为ρg/cm3,质量分数为ω,物质的量浓度为c mol/L,NA表示阿伏加德罗常数,则下列叙述中正确的是
A.所得溶液的物质的量浓度:c=1 mol/L,
B.所得溶液中含有NA个HCl分子
C.36.5 g HCl气体占有的体积为22.4 L
D.所得溶液的质量分数:ω=36.5 c/1000P
查看答案和解析>>
科目:高中化学 来源: 题型:
有Na2SO4 和 Fe2(SO4)3 的混合溶液,已知其中 Fe3+的物质的量浓度为0.4 mol/L,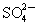 的物质的量浓度为0.7 mol/L,则此溶液中Na+的物质的量浓度为
的物质的量浓度为0.7 mol/L,则此溶液中Na+的物质的量浓度为
A.0.1 mol/L B.0.15 mol/L C.0.2 mol/L D.0.25 mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
Na、Cu、O、Si、S、Cl是常见的六种元素。
(1)Na位于元素周期表中 ;S的基态原子核外有 个未成对电子;Si的基态原子核外电子排布式为 。
(2)用“>”或“<”填空:
| 第一电离能 | 离子半径 | 熔点 | 酸性 |
| Si S | O2- Na+ | NaCl Si | H2SO4 HClO4 |
(3)CuCl(s)与O2反应生成CuCl2(s)和一种黑色固体。在25 ℃、101KPa下,已知该反应每消耗1 mol CuCl(s),放热44.4KJ,该反应的热化学方程式是 。
(4)ClO2是常用于水的净化,工业上可用Cl2氧化NaClO2溶液制取ClO2。写出该反应的离子方程式 。
查看答案和解析>>
科目:高中化学 来源: 题型:
短周期元素X、Y、Z,其中X、Z同主族,Y、Z同周期,Z原子最外层电子数是X原子内层电子数的3倍,是Y原子最外层电子数的2倍。下列说法错误的是
A.Y位于第3周期 B.含X、Z的酸不只一种
C.原子半径:Y > Z D.气态氢化物稳定性:Z > X
查看答案和解析>>
科目:高中化学 来源: 题型:
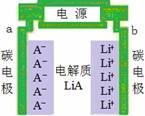
正、负极都是碳材料的双碳性电池,电池充、放电过程为2nC+LiA  CnA+LiCn,充电时Li+、A-分别吸附在两极上形成LiCn和CnA(如图所示),下列说法正确的是
CnA+LiCn,充电时Li+、A-分别吸附在两极上形成LiCn和CnA(如图所示),下列说法正确的是
A.a是电池的负极
B.放电时,A-离子向b极移动
C.放电时,负极的电极反应式是nC-e-+A-= CnA
D.充电时,电解质中的离子浓度保持不变
查看答案和解析>>
科目:高中化学 来源: 题型:
在10 L恒容密闭容器中充入X(g)和Y(g),发生反应X(g)+Y(g)  M(g)+N(g),所得实验数据如下表:
M(g)+N(g),所得实验数据如下表:
| 实验 编号 | 温度/℃ | 起始时物质的量/mol | 平衡时物质的量/mol | ||
| n(X) | n(Y) | n(M) | |||
| ① | 700 | 0.40 | 0.10 | 0.090 | |
| ② | 800 | 0.10 | 0.40 | 0.080 | |
| ③ | 800 | 0.20 | 0.30 | a | |
| ④ | 900 | 0.10 | 0.15 | b | |
下列说法正确的是( )
A.实验①中,若5 min时测得n(M)=0.050 mol,则0至5 min时间内,用N表示的平均反应速率v(N)=1.0×10-2 mol·L-1·min-1
B.实验②中,该反应的平衡常数K=2.0
C.实验③中,达到平衡时,X的转化率为60%
D.实验④中,达到平衡时,b>0.0 60
60
查看答案和解析>>
科目:高中化学 来源: 题型:
NaHSO3溶液在不同温度下均可被过量KIO3氧化,当NaHSO3完全消耗即有I2析出,依据I2析出所需时间可以求得NaHSO3的反应速率。将浓度均为0.020 mol·L-1的NaHSO3溶液(含少量淀粉)10.0 mL、KIO3(过量)酸性溶液40.0 mL混合,记录10~55 ℃间溶液变蓝时间,55 ℃时未观察到溶液变蓝,实验结果如下图。据图分析,下列判断不正确的是( )
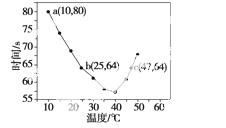
A.40 ℃之前与40 ℃之后溶液变蓝的时间随温度的变化趋势相反
B.图中b、c两点对应的NaHSO3反应速率相等
C.图中a点对应的NaHSO3反应速率为5.0×10-5 mol·L-1·s-1
D.温度高于40 ℃时,淀粉不宜用作该实验的指示剂
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com