
下列表示对应化学反 应的离子方程式正确的是
应的离子方程式正确的是
A. 碳酸钙溶于醋酸:CaCO3 + 2H+ = Ca2++ CO2↑+H2O
B.苯酚钠溶液中通入少量的CO2:
C.用铜做电极电解CuSO4溶液:2Cu2 ++2H2O
++2H2O 2Cu↓+O2↑+4H+
2Cu↓+O2↑+4H+
D.用银氨溶液检验乙醛中的醛基:CH3CHO+2Ag(NH3)2+ +2OH-
CH3COO-+NH4++3NH3+2Ag↓+H2O
 小学生10分钟口算测试100分系列答案
小学生10分钟口算测试100分系列答案科目:高中化学 来源: 题型:
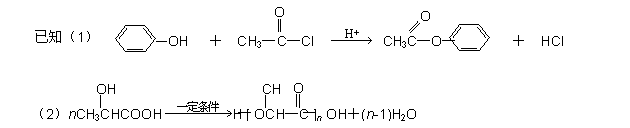 苯酚是一种重要的化工原料,以下是以苯酚为原料,生产阿司匹林、香料和高分子化合物的合成线路图。
苯酚是一种重要的化工原料,以下是以苯酚为原料,生产阿司匹林、香料和高分子化合物的合成线路图。
 (3)R—OH+HBr
(3)R—OH+HBr R—Br+H2O
R—Br+H2O
(1)写出反应类型:反应④属于_____________反应,反应③属于________________反应。
(2)写出下列有机物的结构简式:E___________、G_____________、F____________。
(3)可以检验阿司匹林样品中含有水杨酸的试剂是__________(填写字母)。
A.碳酸氢钠溶液 B.氯化铁溶液 C.红色石蕊试液 D.新制氢氧化铜悬浊液
(4)与阿司匹林互为同分异构体的物质有多种,请按以下要求写出阿司匹林的一种同分异构体:①苯环上有两个对位的取代基;②能发生银镜反应;③含有酯基和羧基的有机物________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【化学——选修2化学与技术】
铝生产产业链由铝土矿开采、氧化铝制取、铝的冶炼和铝材加工等环节构成。请回答下列问题:
⑴工业上采用电解氧化铝-冰晶石(Na3AlF6)熔融体的方法冶炼得到金属铝:
2Al2O3  4Al+3O2↑加入冰晶石的作用:_______________________________。
4Al+3O2↑加入冰晶石的作用:_______________________________。
⑵上述工艺所得铝材中往往含有少量Fe和Si等杂质,可用电解方法进一步提纯,该电解池中阳极的电极反应式为 ,下列可作阴极材料的是________________。
A.铝材 B.石墨 C.铅板 D.纯铝
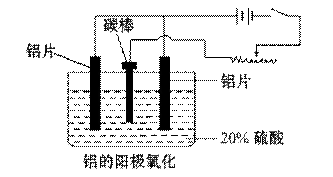
⑶阳极氧化能使金属表面生成致密的氧化膜。以稀硫酸为电解液,铝阳极发生的电极反应式为__________________________________。
⑷在铝阳极氧化过程中,需要不断地调整电压,理由是____________ 。
⑸下列说法正确的是 。
A. 阳极氧化是应用原电池原理进行金属材料表面处理的技术
B. 铝的阳极氧化可增强铝表面的绝缘性能
C. 铝的阳极氧化可提高金属铝及其合金的耐腐蚀性,但耐磨性下降
D. 铝的阳极氧化膜富有多孔性,具有很强的吸附性能,能吸附染料而呈各种颜色
查看答案和解析>>
科目:高中化学 来源: 题型:
把锌片和铜片用导线相连后插入稀硫酸溶液中构成原电池。对该电池的描述合理的是①溶液中硫酸的物质的量浓度保持不变;②Cu极上有气泡产生,发生还原反应;③Cu为负极,Zn为正极;④原电池在工作时电子由负极通过溶液流向正极;⑤该装置将化学能转变为电能( )
A.④⑤ B.③⑤ C.①② D.②⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
美国亚利桑那州大学(ASU)和阿贡国家实验室的 科学家最近设计出生产氢气的人造树叶,原理为:
科学家最近设计出生产氢气的人造树叶,原理为:
2H2O(g) 2H2(g)+O2(g)
2H2(g)+O2(g) 。有关该反应的说法正确的是
。有关该反应的说法正确的是
A.△H <0 B.△S <0
C.化学能转变为电能 D.氢能是理想的绿色能源
查看答案和解析>>
科目:高中化学 来源: 题型:
常温下,0.010mol·L-1NaI溶液与Pd(NO3)2溶液等体积混合,若有PdI2沉淀生成[已知:Ksp(PdI2)=7.0×10-9],则原Pd(NO3)2溶液最低浓度为
A.7.0×10-7 mol·L-1 B.2.8×10-4 mol·L-1
C.5.6×10-4 mol·L-1 D.7.0×10-5 mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
NaH2PO4、Na2HPO4可用于合成化工原料三聚磷酸钠(Na5P3O10)。
(1)能说明NaH2PO4溶液显弱酸性原因的离子方程式为 ▲ 。
(2)能说明Na2HPO4溶液显弱碱性原因的离子方程式为 ▲ 。
(3)测定某三聚磷酸钠试样中Na5P3O10的含量可用间接滴定法,其流程如下:
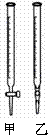

①滴定时所用的指示剂X可为 ▲ 。
②NaOH标准溶液应盛放在右上图所示的滴定管  ▲ (选填:“甲”或“乙”) 中。
▲ (选填:“甲”或“乙”) 中。
③滴定实验记录如下表(样品中杂质不与酸或碱反应)。
| 滴定次数 | 待测溶液A的体积(/mL) | 0.1000mol·L-1NaOH溶液的体积 | |
| 滴定前读数(/mL) | 滴定后读数(/mL) | ||
| 1 | 25.00 | 1.02 | 21.03 |
| 2 | 25.00 | 2.00 | 21.99 |
| 3 | 25.00 | 0.20 | 20.20 |
试计算样品中Na5P3O10的质量分数(列出计算过程,结果保留三位有效数字)。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列热化学方程式书写正确且对应的△H与括号内表述相符的是
A.2H2 (g) + O2 (g) = 2H2O (l) ΔH = -571.6 kJ/mol(燃烧热)
B.NaOH(aq)+ CH3COOH(aq)=CH3COONa(aq)+H2O(l);
△H=-57.3kJ/mol(中和热)
C.H2O (g) = H2 (g) +  O2 (g) ΔH = -242 kJ/mol (反应热)
O2 (g) ΔH = -242 kJ/mol (反应热)
D.C(s)+ O2 ( g ) = CO2(g) ΔH =-393.5 kJ/mol(反应热)
查看答案和解析>>
科目:高中化学 来源: 题型:
某兴趣小组探究SO2气体还原Fe3+、I2,他们使用的药品和装置如下图所示:

(1)SO2与FeCl3溶液反应的离子方程式为________________________________________________________________________
________________________________________________________________________。
(2)下列实验方案适用于在实验室制取所需SO2的是 BD (填序号)。
A.Na2SO3溶液与HNO3 B.Na2SO3固体与浓硫酸
C.固体硫在纯氧中燃烧 D.铜与热浓H2SO4
(3)装置C的作用是 吸收SO2尾气,防止污染空气 。
(4)若要从A中所得溶液提取晶体,必须进行的实验操作步骤:蒸发、冷却结晶、 过滤 、自然干燥,在这一系列操作中没有用到的仪器有 BF (填序号)。
A.蒸发皿 B.石棉网 C.漏斗
D.烧杯 E.玻璃棒 F.坩埚
(5)在上述装置中通入过量的SO2,为了验证A中SO2与Fe3+发生了氧化还原反应,他们取A中的溶液,分成三份,并设计了如下实验:
方案①:往第一份试液加入KMnO4溶液,紫红色褪去。
方案②:往第二份试液加入KSCN溶液,不变红,再加入新制的氯水,溶液变红。
方案③:往第三份试液加入用稀盐酸酸化的BaCl2,产生白色沉淀。
上述方案不合理的是 方案① ,原因是 A的溶液中含有SO2,SO2也能使KMnO4溶液褪色 。
(6)能表明I-的还原性弱于SO2的现象是 B中蓝色溶液褪色 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com