
| A. | 反应速率用于衡量化学反应进行的快慢 | |
| B. | 决定反应速率的主要因素是反应物的性质 | |
| C. | 反应速率越大,反应现象就一定越明显 | |
| D. | 增大反应物的浓度、提高反应温度都能增大反应速率 |
分析 化学反应速率为单位时间内浓度的变化,可用于衡量化学反应进行的快慢,影响化学反应速率的主要因素为物质的性质,温度、浓度、催化剂等为外界因素,也是次要原因,一般来说,增大浓度、压强等,可增大反应速率,以此解答该题.
解答 解:A.化学反应有的快,有的慢,则使用化学反应速率来定量表示化学反应进行的快慢,故A正确;
B.反应物本身的性质是决定反应速率的主要因素,如火药爆炸、食物腐败,故B正确;
C.反应速率大,不一定有明显的现象,如酸碱中和反应,故C错误;
D.增大反应物的浓度、提高反应温度,可增大活化分子的浓度、百分数等,反应速率增大,故D正确.
故选C.
点评 本题考查化学反应速率的因素,为高频考点,题目难度不大,注意影响化学反应速率的主要原因是物质的性质,为内因,温度、浓度、压强、催化剂等为外因.


 智慧课堂密卷100分单元过关检测系列答案
智慧课堂密卷100分单元过关检测系列答案 单元期中期末卷系列答案
单元期中期末卷系列答案科目:高中化学 来源: 题型:选择题
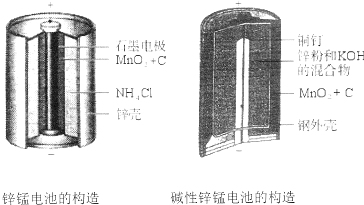
| A. | 该电池反应中二氧化锰起催化作用 | |
| B. | 电池负极反应式为:2MnO2+2e-+2H2O═2MnOOH+2OH- | |
| C. | 当0.1molZn完全反应时,流经电池内部的电子个数为1.204×1023 | |
| D. | 碱性锌锰电池用锌粉替代了原锌锰电池的锌壳,增大了反应物的接触面积,加快了反应速率,故放电电流大 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 金属钠保存在煤油中 | |
| B. | 氢氟酸保存在玻璃试剂瓶中 | |
| C. | 漂白粉必须密封保存 | |
| D. | 氢氧化钠溶液保存在带橡胶塞的试剂瓶中 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 俄国化学家门捷列夫于1869年发表了第一张元素周期表 | |
| B. | 现代化学常利用原子光谱的特征谱线来测定分子的结构 | |
| C. | DNA双螺旋的两个螺旋链是用氢键相结合的 | |
| D. | 区分晶体和非晶体最可靠的科学方法是X-射线衍射实验 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1 g H2和1 g O2 | |
| B. | 5.6 L N2(标准状况)和22 g CO2 | |
| C. | 9 g H2O(非标准状况)和11.2 L(标准状况)Cl2 | |
| D. | 22.4 L H2(标准状况)和0.1 mol N2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 中子数为20的氯原子:${\;}_{17}^{37}$Cl | |
| B. | 次氯酸的电离方程式:HClO=H++ClO- | |
| C. | Na+的结构示意图: | |
| D. | 赤铁矿的主要成分:Fe3O4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
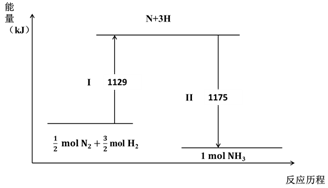
| A. | Ⅰ过程中破坏的均为非极性键 | |
| B. | Ⅰ过程吸收能量,II过程放出能量 | |
| C. | N2(g)+3H2(g)?2NH3(g)△H=-44 kJ•mol-1 | |
| D. | 1mol N2(g)与3 mol H2(g)所具有的总能量比2 mol NH3(g) 所具有的总能量高 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH3OH的标准燃烧热为△H=-192.9 kJ•mol-1 | |
| B. | 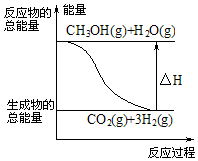 反应①中的能量变化如图所示 | |
| C. | CH3OH转变成H2的过程一定要吸收能量 | |
| D. | 根据②推知反应:CH3OH(l)+$\frac{1}{2}$O2(g)=CO2(g)+2H2(g)的△H>-192.9kJ•mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com