
 “―÷ΣΡ≥Έ¬Ε» ±CH3COOHΒΡΒγάκΤΫΚβ≥Θ ΐΈΣKΓΘΗΟΈ¬Ε»œ¬œρ20 mL 0.1 molΓΛLΘ≠1 CH3COOH»ή“Κ÷–÷πΒΈΦ”»κ0.1 molΓΛLΘ≠1 NaOH»ή“ΚΘ§ΤδpH±δΜ·«ζœΏ»γΆΦΥυ Ψ(Κω¬‘Έ¬Ε»±δΜ·)ΓΘœ¬Ν–ΥΒΖ®÷–≤Μ’ΐ»ΖΒΡ «
“―÷ΣΡ≥Έ¬Ε» ±CH3COOHΒΡΒγάκΤΫΚβ≥Θ ΐΈΣKΓΘΗΟΈ¬Ε»œ¬œρ20 mL 0.1 molΓΛLΘ≠1 CH3COOH»ή“Κ÷–÷πΒΈΦ”»κ0.1 molΓΛLΘ≠1 NaOH»ή“ΚΘ§ΤδpH±δΜ·«ζœΏ»γΆΦΥυ Ψ(Κω¬‘Έ¬Ε»±δΜ·)ΓΘœ¬Ν–ΥΒΖ®÷–≤Μ’ΐ»ΖΒΡ «
AΘ°aΒψ ±Θ§CH3COOHΒΡΒγάκΕ» «1%
BΘ°bΒψ ±Θ§»ή“Κ÷–c(CH3COOΘ≠)ΘΨc(NaΘΪ)
CΘ°cΒψ±μ ΨCH3COOHΚΆNaOH«ΓΚΟΖ¥”ΠΆξ»Ϊ
DΘ°bΓΔdΒψ±μ ΨΒΡ»ή“Κ÷– ΨυΒ»”ΎK
ΨυΒ»”ΎK
 ΧλΧλœρ…œ“Μ±ΨΚΟΨμœΒΝ–¥πΑΗ
ΧλΧλœρ…œ“Μ±ΨΚΟΨμœΒΝ–¥πΑΗ –Γ―ß…ζ10Ζ÷÷””Π”ΟΧβœΒΝ–¥πΑΗ
–Γ―ß…ζ10Ζ÷÷””Π”ΟΧβœΒΝ–¥πΑΗ
| ΡξΦΕ | ΗΏ÷–ΩΈ≥Χ | ΡξΦΕ | ≥θ÷–ΩΈ≥Χ |
| ΗΏ“Μ | ΗΏ“ΜΟβΖ―ΩΈ≥ΧΆΤΦωΘΓ | ≥θ“Μ | ≥θ“ΜΟβΖ―ΩΈ≥ΧΆΤΦωΘΓ |
| ΗΏΕΰ | ΗΏΕΰΟβΖ―ΩΈ≥ΧΆΤΦωΘΓ | ≥θΕΰ | ≥θΕΰΟβΖ―ΩΈ≥ΧΆΤΦωΘΓ |
| ΗΏ»ΐ | ΗΏ»ΐΟβΖ―ΩΈ≥ΧΆΤΦωΘΓ | ≥θ»ΐ | ≥θ»ΐΟβΖ―ΩΈ≥ΧΆΤΦωΘΓ |
ΩΤΡΩΘΚΗΏ÷–Μ·―ß ά¥‘¥ΘΚ Χβ–ΆΘΚ
“―÷ΣΖ¥”ΠΔΌ2BrO3- + Cl2 =Br2 +2ClO3- ΔΎ5Cl2 + I2 +6H2O=2HIO3 +10HClΔέClO3- +5Cl-+6H+=3Cl2 +3H2O,œ¬Ν–Έο÷ ―θΜ·ΡήΝΠ«Ω»θΥ≥–ρ’ΐ»ΖΒΡ «ΘΚΘ® Θ©C
AΘ°ClO3-ΘΨBrO3-ΘΨIO3-ΘΨCl2 BΘ°BrO3- ΘΨCl2ΘΨC1O3-ΘΨIO3-
CΘ°BrO3-ΘΨClO3-ΘΨCl2ΘΨIO3- DΘ°Cl2ΘΨBrO3-ΘΨC1O3-ΘΨIO3-
≤ιΩ¥¥πΑΗΚΆΫβΈω>>
ΩΤΡΩΘΚΗΏ÷–Μ·―ß ά¥‘¥ΘΚ Χβ–ΆΘΚ
œ¬Ν–Μ·ΚœΈο÷–―τάκΉ”ΑκΨΕ”κ“θάκΉ”ΑκΨΕ±»÷ΒΉν¥σΒΡ «
AΘ°NaF BΘ°LiI CΘ°MgI2 DΘ°KF
≤ιΩ¥¥πΑΗΚΆΫβΈω>>
ΩΤΡΩΘΚΗΏ÷–Μ·―ß ά¥‘¥ΘΚ Χβ–ΆΘΚ
œ¬Ν–Υ°ΫβΒΡάκΉ”ΖΫ≥Χ Ϋ’ΐ»ΖΒΡ «
AΘ°HSΘ≠ΘΪH2O S2-ΘΪH3O+
S2-ΘΪH3O+
BΘ°Fe3ΘΪΘΪ3H2O Fe(OH)3ΓΐΘΪ3HΘΪ
Fe(OH)3ΓΐΘΪ3HΘΪ
CΘ°CO32Θ≠ΘΪ2H2O H2CO3ΘΪ2OHΘ≠
H2CO3ΘΪ2OHΘ≠
DΘ°NH4ΘΪΘΪH2O NH3ΓΛH2OΘΪHΘΪ
NH3ΓΛH2OΘΪHΘΪ
≤ιΩ¥¥πΑΗΚΆΫβΈω>>
ΩΤΡΩΘΚΗΏ÷–Μ·―ß ά¥‘¥ΘΚ Χβ–ΆΘΚ
Ρ≥ΤχΧ§Χΰ1 molΡή”κ2 mol HClΆξ»ΪΦ”≥…Θ§Φ”≥…Κσ≤ζΈοΖ÷Ή”…œΒΡ«β‘≠Ή””÷Ω…±Μ6 mol Cl2»Γ¥ζΘ§‘ρ¥ΥΤχΧ§ΧΰΩ…Ρή «
AΘ°CH3ΓΣCΓ‘CΓΣCH3 BΘ° CH2ΘΫCH2
CΘ°CHΓ‘CΓΣCH3 DΘ°CH2ΘΫCHΓΣCH3
≤ιΩ¥¥πΑΗΚΆΫβΈω>>
ΩΤΡΩΘΚΗΏ÷–Μ·―ß ά¥‘¥ΘΚ Χβ–ΆΘΚ
–νΒγ≥Ί «“Μ÷÷Ω…“‘Ζ¥Η¥≥δΒγΓΔΖ≈ΒγΒΡΉΑ÷ΟΓΘ”–“Μ÷÷–νΒγ≥Ί‘Ύ≥δΒγΚΆΖ≈Βγ ±ΖΔ…ζΒΡΖ¥”Π «ΘΚNiO2 + Fe + 2H2O Fe(OH)2 + Ni(OH)2ΓΘ
Θ®1Θ©»τ¥Υ–νΒγ≥ΊΖ≈Βγ ±Θ§ΗΟΒγ≥ΊΡ≥“ΜΒγΦΪΖΔ…ζΜΙ‘≠Ζ¥”ΠΒΡΈο÷ « Θ®Χν–ρΚ≈Θ©ΓΘ
AΘ°NiO2 BΘ°Fe CΘ°Fe(OH)2 DΘ°Ni(OH)2
Θ®2Θ©”Ο¥Υ–νΒγ≥ΊΖ÷±πΒγΫβ“‘œ¬ΝΫ÷÷»ή“ΚΘ§ΦΌ»γΒγ¬Ζ÷–ΉΣ“ΤΝΥ0.02 mole-Θ§«“ΒγΫβ≥ΊΒΡΒγΦΪΨυΈΣΕη–‘ΒγΦΪΘ§ ‘ΜΊ¥πœ¬Ν–Έ ΧβΓΘ
ΔΌ ΒγΫβM(NO3)x»ή“Κ ±Ρ≥“ΜΒγΦΪ‘ωΦ”ΝΥ g MΘ§‘ρΫπ τMΒΡœύΕ‘‘≠Ή”÷ ΝΩΈΣ Θ®”ΟΚ§ΓΑ
g MΘ§‘ρΫπ τMΒΡœύΕ‘‘≠Ή”÷ ΝΩΈΣ Θ®”ΟΚ§ΓΑ ΓΔxΓ±ΒΡ±μ¥ο Ϋ±μ ΨΘ©ΓΘ
ΓΔxΓ±ΒΡ±μ¥ο Ϋ±μ ΨΘ©ΓΘ
ΔΎ ΒγΫβΚ§”–0.01 mol CuSO4ΚΆ0.01 mol NaClΒΡΜλΚœ»ή“Κ100mLΘ§―τΦΪ≤ζ…ζΒΡΤχΧε‘Ύ±ξΉΦΉ¥Ωωœ¬ΒΡΧεΜΐ « ΘΜΫΪΒγΫβΚσΒΡ»ή“ΚΦ”Υ°œΓ Ά÷Ν1LΘ§¥Υ ±»ή“ΚΒΡPH= ΓΘ
≤ιΩ¥¥πΑΗΚΆΫβΈω>>
ΩΤΡΩΘΚΗΏ÷–Μ·―ß ά¥‘¥ΘΚ Χβ–ΆΘΚ
‘Ύ≥ΘΈ¬œ¬Θ§œ¬Ν–”–ΙΊ»ή“Κ÷–ΈΔΝΘΒΡΈο÷ ΒΡΝΩ≈®Ε»ΙΊœΒ’ΐ»ΖΒΡ «
AΘ°1L0.1molΓΛL-1(NH4)2Fe(SO4)2ΓΛ6H2OΒΡ»ή“Κ÷–ΘΚc(NH4ΘΪ)ΘΪc(Fe2ΘΪ)ΘΪc(HΘΪ)ΘΫc(OHΓΣ)ΘΪc (SO42ΓΣ)
BΘ°0.1 molΓΛL-1 NH4HS»ή“Κ÷–ΘΚc(NH4ΘΪ)ΘΦc(HSΘ≠)ΘΪc(H2S)ΘΪc(S2Θ≠)
CΘ°0.1molΓΛL-1pHΈΣ4ΒΡNaHA»ή“Κ÷–ΘΚc(HAΘ≠)ΘΨc(H2A)ΘΨc(A2Θ≠)
DΘ°Β»≈®Ε»ΒΡΧΦΥαΡΤΚΆΧΦΥα«βΡΤ»ή“ΚΜλΚœΚσΒΡ»ή“Κ÷–ΘΚc(OHΘ≠)+c(CO32Θ≠)ΘΫc(HCO3Θ≠)+c(H2CO3)+c(H+)
≤ιΩ¥¥πΑΗΚΆΫβΈω>>
ΩΤΡΩΘΚΗΏ÷–Μ·―ß ά¥‘¥ΘΚ Χβ–ΆΘΚ
œ¬Ν–ΙΊ”Ύ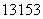 IΒΡΥΒΖ®’ΐ»ΖΒΡ «
IΒΡΥΒΖ®’ΐ»ΖΒΡ «
AΘ°÷ ΝΩ ΐΈΣ53 BΘ°÷–Ή” ΐΈΣ78 CΘ°÷ Ή” ΐΈΣ131 DΘ°ΒγΉ” ΐΈΣ78
≤ιΩ¥¥πΑΗΚΆΫβΈω>>
ΩΤΡΩΘΚΗΏ÷–Μ·―ß ά¥‘¥ΘΚ Χβ–ΆΘΚ
œ¬Ν–»»Μ·―ßΖΫ≥Χ Ϋ’ΐ»ΖΒΡ «(ΓΓΓΓ)
AΘ°2SO2ΘΪO2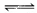 2SO3ΓΓΠΛHΘΫΘ≠196.6 kJΓΛmolΘ≠1
2SO3ΓΓΠΛHΘΫΘ≠196.6 kJΓΛmolΘ≠1
BΘ°C(g)ΘΪO2(g)===CO(g)ΓΓΠΛHΘΫ393.5 kJΓΛmolΘ≠1
CΘ°H2(g)ΘΪ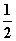 O2(g)===H2O(g)ΓΓΠΛHΘΫΘ≠241.8 kJ
O2(g)===H2O(g)ΓΓΠΛHΘΫΘ≠241.8 kJ
DΘ°2H2(g)ΘΪO2(g)===2H2O(l)ΓΓΠΛHΘΫΘ≠571.6 kJΓΛmolΘ≠1
≤ιΩ¥¥πΑΗΚΆΫβΈω>>
ΑΌΕ»÷¬–≈ - ΝΖœΑ≤αΝ–±μ - ‘ΧβΝ–±μ
Κΰ±± ΓΜΞΝΣΆχΈΞΖ®ΚΆ≤ΜΝΦ–≈œΔΨΌ±®ΤΫΧ® | Άχ…œ”–ΚΠ–≈œΔΨΌ±®Ή®«χ | Βγ–≈’©Τ≠ΨΌ±®Ή®«χ | …φάζ Ζ–ιΈό÷ς“ε”–ΚΠ–≈œΔΨΌ±®Ή®«χ | …φΤσ«÷»®ΨΌ±®Ή®«χ
ΈΞΖ®ΚΆ≤ΜΝΦ–≈œΔΨΌ±®ΒγΜΑΘΚ027-86699610 ΨΌ±®” œδΘΚ58377363@163.com