
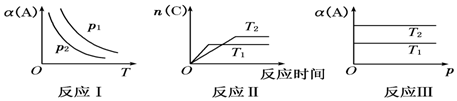
分析 (1)反应Ⅰ中恒压下温度升高,α(A)减小,即升高温度平衡向左移动,△H<0;恒定温度时压强越大,α(A)越大,说明此a+b>c,即为熵减反应,△S<0;放热、熵减反应只能在低温下自发进行;
(2)“先拐先平数值大”T2温度下反应先达到平衡状态,说明T2>T1,温度越高,平衡时C的物质的量越小,即升高温度平衡向左移动,则正反应为放热反应;
(3)恒温下压强变化对α(A)没有影响,说明a+b=c,△S≈0,若T1<T2,恒压下温度越高α(A)越大,说明升高温度平衡向右移动,正反应为吸热反应,△H>0,则△H-T△S>0,反应不能自发进行.
解答 解:(1)反应Ⅰ中恒压下温度升高,α(A)减小,即升高温度平衡向左移动,则正反应为放热反应,△H<0;由p1>p2知恒定温度时压强越大,α(A)越大,即增大压强平衡向右移动,说明此反应为气体分子数减少的反应(a+b>c),即为熵减反应,△S<0.放热、熵减反应只能在低温下自发进行,如逆反应自发进行,应在高温下,
故答案为:放热;<;高温;
(2)反应Ⅱ中先拐先平温度高,T1温度下反应先达到平衡状态,说明T1>T2;温度越高,平衡时C的物质的量越小,即升高温度平衡向左移动,则正反应为放热反应,△H<0,
故答案为:>;放热;
(3)反应Ⅲ中在恒温下压强变化对α(A)没有影响,说明压强变化不能影响平衡,此反应为气体分子数不变的反应(a+b=c),反应过程中熵变很小,△S≈0,若T1<T2,恒压下温度越高α(A)越大,说明升高温度平衡向又移动,正反应为吸热反应,△H>0,则△H-T△S<0,反应不能自发进行,
故答案为:不能.
点评 本题涉及图象的分析及化学平衡的移动和反应进行的方向等知识点,为高频考点,侧重于学生的分析能力的考查,题目整合性较强,通过图象中数据的变化判断化学平衡移动的方向是解题的关键,题目难度中等.


科目:高中化学 来源: 题型:选择题
 用如图表示的一些物质或概念之间的从属或包含关系中,错误的是( )
用如图表示的一些物质或概念之间的从属或包含关系中,错误的是( )| X | Y | Z | |
| 例 | 氧化物 | 化合物 | 纯净物 |
| A | 碘酒 | 分散系 | 混合物 |
| B | 液氯 | 电解质 | 化合物 |
| C | 硫酸钠 | 盐 | 纯净物 |
| D | NaHSO4 | 酸式盐 | 电解质 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 ;
;查看答案和解析>>
科目:高中化学 来源: 题型:解答题
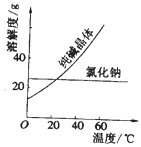
| 物质 | 熔点/℃ | 沸点/℃ | 密度/g•cm-3 | 溶解性 |
| 乙二醇( C2H6O2) | -11.5 | 198 | 1.11 | 易溶于水和乙醇 |
| 丙三醇(C3H8O3) | 17.9 | 290 | 1.26 | 能跟水、酒精以任意比互溶 |
查看答案和解析>>
科目:高中化学 来源:2016-2017学年河北省高一上10月月考化学试卷(解析版) 题型:选择题
以下是对某水溶液进行离子检验的方法和结论,其中正确的是
A.先加入BaCl2溶液,再加入足量HNO3溶液,产生白色沉淀,溶液中一定含有大量SO42-
B.加入足量的CaCl2溶液,产生了白色沉淀。溶液中一定含有大量的CO32-
C.加入足量浓 NaOH溶液,产生带有强烈刺激性气味的气体,溶液中一定含有大量NH4+
D.先加适量盐酸将溶液酸化,再加AgNO3溶液,产生白色沉淀,溶液中一定含有大量Cl-
查看答案和解析>>
科目:高中化学 来源:2016-2017学年甘肃省高二上第一次学段考试化学卷(解析版) 题型:选择题
海洋中有丰富的食品、矿产、能源、药物和水产资源,下图为海水利用的部分过程。
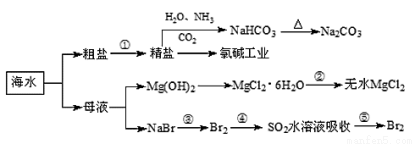
下列有关说法正确的是( )
A.在第③、④、⑤步骤中,溴元素均被氧化
B.制取NaHCO3的反应是利用其在此反应所涉及物质中溶解度最小
C.用澄清的石灰水可鉴别NaHCO3和Na2CO3
D.工业上通过电解饱和MgCl2溶液制取金属镁
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com