
【题目】美国《Science》上发表论文,宣布发现了一种 Al 的超原子结构,这种超原子(Al13)是以 1 个 Al 原子 在中心,12 个 Al 原子在表面形成的三角二十面体结构。这种超原子具有 40 个价电 子(价电 子即主族元 素的最外层电子数)时最稳定。请预测稳定的 Al13 所带的电荷为
A. -1 B. +2 C. +3 D. 0
 阶梯计算系列答案
阶梯计算系列答案科目:高中化学 来源: 题型:
【题目】下列反应过程中同时有离子键、极性共价键和非极性共价键的断裂和形成的反应是
A. H2+CuO![]() Cu+H2OB. 2Na2O2+2H2O===4NaOH+O2↑
Cu+H2OB. 2Na2O2+2H2O===4NaOH+O2↑
C. 2KClO3+MnO2![]() 2KCl+3O2↑D. 2NaOH+Cl2===NaCl+NaClO+H2O
2KCl+3O2↑D. 2NaOH+Cl2===NaCl+NaClO+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】丁烷催化裂化时碳链按两种方式断裂,生成两种烷烃和两种烯烃。如果丁烷的裂化率为60%,且裂化生成的两种烯烃物质的量相等,则裂化后得到的含氢质量分数最高的气体占混合气体的体积分数为
A. 18.75% B. 30% C. 15% D. 22.5%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组物质,按酸、碱、盐、非电解质的顺序排列的是( )
A.硫酸、胆矾、氯化镁、二氧化碳B.硝酸、纯碱、干冰、苏打水
C.醋酸、消石灰、明矾、铜D.氯化氢、苛性钠、NaHCO3、氨气
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表为周期表前20号元素中某些元素的有关数据:
元素性质 | ① | ② | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | ⑩ |
原子半径(10-10m) | 1.86 | 1.52 | 0.66 | 0.53 | 0.77 | 1.10 | 0.99 | 2.31 | 0.70 | 0.64 |
最高价态 | +1 | +1 | —— | +1 | +4 | +5 | +7 | +1 | +5 | —— |
最低价态 | —— | —— | -2 | -1 | -4 | -3 | -1 | —— | -3 | -1 |
试回答下列问题:(用对应的元素符号或物质的化学式表示)
(1)写出⑧的原子结构示意图:________;
(2)上述⑤、⑥、⑦号元素中某2种元素形成的化合物中,每一个原子都满足最外层为8电子稳定结构的物质可能是______、____;
(3)某元素R的原子半径为1.04×10-10m,该元素在周期表中的位置是___________。
(4)以上10种元素的原子中,还原性最强的是__________(元素符号)。
(5)③、⑦、①、⑩四种元素形成的离子,其半径由小到大的顺序为___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按题给要求填空
(1)某烷烃1分子含有50个电子,该烷烃只能由一种结构的炔烃加氢得到,则该烷烃的结构简式为_________________或_________________ 。
(2)分子式为C6H12 的某烃的所有碳原子都在同一平面上,则该烃的结构简式为_____________________________,若分子式为C4H6的某烃中所有的碳原子都在同一条直线上,则该烃的结构简式为_____________________________________。
(3)写出以乙炔为原料制备聚氯乙烯反应方程式(无机物不限)
①___________________________________________________。
②___________________________________________________。
(4)下列卤代烃在 KOH 醇溶液中加热不反应的是_____________________(填序号)。
①![]() ②(CH3)2CHCH2Cl ③
②(CH3)2CHCH2Cl ③![]() ④CHCl2CH2Br
④CHCl2CH2Br
⑤(CH3)3CCH2Cl ⑥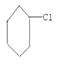 ⑦CH2=CHCl
⑦CH2=CHCl
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】N2O5是一种新型硝化剂,在一定温度下可发生如下反应:2N2O5(g)![]() 4NO2(g)+O2(g) △H>0。T1温度时,向密闭容器中通入N2O5气体,部分实验数据见下表:
4NO2(g)+O2(g) △H>0。T1温度时,向密闭容器中通入N2O5气体,部分实验数据见下表:
时间/s | 0 | 500 | 1000 | 1500 |
c(N2O5)/(mol·L—1) | 5.00 | 3.52 | 2.50 | 2.50 |
下列说法正确的是
A. 500s内O2的平均生成速率为7.4×l0—4mol·L—1·s—1
B. T1温度下该反应达到平衡时,平衡混合物中NO2的体积分数为50%
C. 达到平衡后,其他条件不变,将容器体积压缩到原来的1/2,则c(N2O5)>5.00mol·L—1
D. T1温度下的平衡常数为K1,T2温度下的平衡常数为K2,若K1<K2,则T1>T2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】亚硝酰氯(ClNO)是有机合成中的重要试剂。可通过反应获得:2NO(g)+Cl2(g) ![]() 2ClNO(g)
2ClNO(g)
(1)氢氧化物与悬浮在大气中的海盐粒子相互作用时会生成亚硝酰氯,涉及如下反应:
①2NO2(g)+NaCl(s) ![]() NaNO3(s)+ClNO(g) K1
NaNO3(s)+ClNO(g) K1
②4NO2(g)+2NaCl(s) ![]() 2NaNO3(s)+2NO(g)+Cl2(g) K2
2NaNO3(s)+2NO(g)+Cl2(g) K2
③2NO(g)+Cl2(g) ![]() 2ClNO(g) K3
2ClNO(g) K3
则K3=______________(用K1和K2表示)。
(2)按投料比[n(NO):n(Cl2)=2:1]把NO和Cl2加入到一恒压的密闭容器中发生反应,平衡时NO的转化率与温度T、压强P(总压)的关系如图A所示:
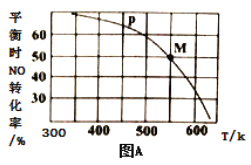
①该反应的△H______0(填“>”“<”或“=”);
②在P压强条件下,M点时容器内NO的体积分数为_________;
③若反应一直保持在P压强条件下进行,则M点的分压平衡常数Kp=__________(用含P的表达式表示,用平衡分压代替平衡浓度计算,分压=总压×体积分数)。
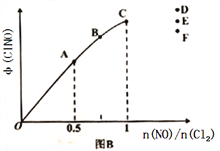
(3)一定条件下在恒温恒容的密闭容器中按一定比例充入NO(g)和Cl2(g),平衡时ClNO的体积分数的变化图像如图B,则A、B、C三状态中,NO的转化率最大的是_________点;当n(NO)/n(Cl2)=1.5时,达到平衡状态ClNO的体积分数可能是D、E、F三点中的_____________点。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com