
【题目】反应N2O4(g)2NO2(g)△H>0,在温度为T1、T2时,平衡体系中NO2的体积分数随压强变化曲线如图所示,下列说法正确的是

A.恒温恒容下,再向B点体系充入N2O4,NO2的体积分数增大
B.图中A、C两点气体的颜色:A浅,C深
C.图中A、C两点气体的平均相对分子质量:A>C
D.温度T1>T2
【答案】B
【解析】
N2O4(g)2NO2(g) △H>0,反应为吸热反应,升高温度,平衡正向移动,NO2的体积分数增大;增大压强,平衡逆向移动,NO2的体积分数减小,以此分析。
A、恒温恒容下,再向B点体系充入N2O4,分析NO2的体积分数变化时按相当于增大压强考虑,NO2的体积分数应该减小,故A错误;
B、增大压强表示体积缩小,浓度增大,所以C点的浓度大,A点的浓度小,则A、C两点气体的颜色:A浅,C深,故B正确;
C、由图象可知,A、C两点都在等温线上,C的压强大,增大压强,化学平衡逆向移动,C点时气体的物质的量小,混合气体的总质量不变,则平均相对分子质量大,即平均相对分子质量:A<C,故C错误;
D、升高温度,化学平衡正向移动,NO2的体积分数增大,由图象可知,A点NO2的体积分数大,则T1<T2,故D错误。
答案选B。


科目:高中化学 来源: 题型:
【题目】下列关于Na2CO3和NaHCO3两种物质有关性质,说法不正确的是( )
A.向Na2CO3和NaHCO3溶液中,滴入酚酞后溶液均变红
B.Na2CO3固体中含有少量NaHCO3可用加热的方法除去
C.向等质量的Na2CO3和NaHCO3固体中加入足量稀盐酸, Na2CO3产生的气体较多
D.分别向盛有少量Na2CO3和NaHCO3的试管中滴入几滴水,振荡后用温度计测量Na2CO3温度高于NaHCO3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、X为中学化学常见物质,且A、B、C含有相同元素甲,可以发生如下转化关系(水参与的反应,水未标出)。
![]()
(1)若A、B、C的焰色反应呈黄色,C为淡黄色固体,则X是__________。
(2)若A、B、C的焰色反应呈黄色,X是CO2,写出B→C反应的方程式_________。
(3)若B是FeCl3,则X一定是_________,写出B→C反应的离子方程式_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】雷雨天闪电时空气中有臭氧生成,下列说法不正确的是![]()
A.![]() 和
和![]() 的相互转化是物理变化
的相互转化是物理变化
B.![]() 和
和![]() 互为同素异形
互为同素异形
C.等物质的量的![]() 和
和![]() 含有的质子数不相同
含有的质子数不相同
D.在相同的温度与压强下,等体积的![]() 和
和![]() 含有相同的分子数
含有相同的分子数
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某溶液可能含有Cl-、SO![]() 、CO
、CO![]() 、NH
、NH![]() 、Fe3+、Al3+和K+。取该溶液100mL,加入过量NaOH溶液,加热,得到0.02mol气体,同时观察到红褐色沉淀,过滤,洗涤,灼烧,得到1.6g固体:向上述滤液中加足量BaCl2溶液,得到4.66g不溶于盐酸的沉淀。由此可知原溶液中( )
、Fe3+、Al3+和K+。取该溶液100mL,加入过量NaOH溶液,加热,得到0.02mol气体,同时观察到红褐色沉淀,过滤,洗涤,灼烧,得到1.6g固体:向上述滤液中加足量BaCl2溶液,得到4.66g不溶于盐酸的沉淀。由此可知原溶液中( )
A.CO![]() 、Al3+一定不存在,K+可能存在
、Al3+一定不存在,K+可能存在
B.Cl-一定存在,且c(Cl-)=0.4mol/L
C.SO![]() 、NH
、NH![]() 一定存在,CO32-可能存在
一定存在,CO32-可能存在
D.原溶液中至少存在上述离子中的4种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下,下列各组离子在指定溶液中能大量共存的是( )
A.0.1molL-1KI溶液:Na+、Ba2+、Fe3+、OH-
B.0.1motL-1Fe2(SO4)3溶液:Zn2+、NH![]() 、Br-、SO
、Br-、SO![]()
C.0.1molL1HNO3溶液:Ba2+、K+、ClO-、Cl-
D.0.1molL-1NaAlO2溶液:Mg2+、Na+、SO![]() 、HCO
、HCO![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)联氨(又称肼,N2H4,无色液体)为二元弱碱,在水中的电离方式与氨相似。写出在水中联氨第一步电离反应的方程式_______________。氯化镁溶液在某条件下可生Mg(OH)Cl沉淀,请写出相关离子方程式_________
(2)实验室可通过向盛装有碱石灰的锥形瓶中滴加浓氨水来制取氨气,请利用相关化学反应原理来解释______________________________
(3)室温下向10mL0.1 mol/L NaOH溶液中加入0.1mol/L的一元酸HA,溶液pH的变化曲线如图所示

则HA为_______电解质(填“强”或“弱”),a点所示溶液c(Na)_____c(A)(填“>”、“<”或“”=),a、b两点所示溶液中水的电离程度a_______b(填“>”、“<”或“"=)。
(4)25℃时0.05mol/L的醋酸溶液,pH=______ 该溶液中水电离出的c(H+)=____(已知室温下醋酸电离平衡常数为2.0×10-5)
(5)常温下,0.01mol/L的HCN溶液加水稀释1000倍的过程中,下列选项增大的是_____
A.![]() B.Kac(HCN) C.
B.Kac(HCN) C.![]() D.
D.![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高锰酸钾常用作消毒杀菌、水质净化剂等。某小组用软锰矿(主要含MnO2,还含有少量SiO2、Al2O3、Fe2O3等杂质)模拟工业制高锰酸钾流程如下。试回答下列问题。
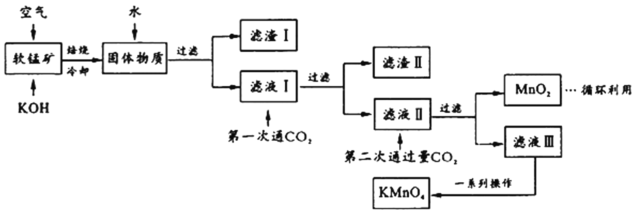
(1)配平焙烧时化学反应:________MnO2+________+________O2![]() ________K2MnO4+________H2O;工业生产中采用对空气加压的方法提高MnO2利用率,试用碰撞理论解释其原因___________________________。
________K2MnO4+________H2O;工业生产中采用对空气加压的方法提高MnO2利用率,试用碰撞理论解释其原因___________________________。
(2)滤渣Ⅱ的成分有_________(化学式);第一次通CO2不能用稀盐酸代替的原因是_____________。
(3)第二次通入过量CO2生成MnO2的离子方程式为________________________。
(4)将滤液Ⅲ进行一系列操作得KMnO4。
由图可知,从滤液Ⅲ得到KMnO4需经过__________、___________、洗涤等操作。
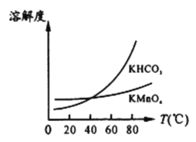
(5)工业上按上述流程连续生产。含MnO2 a%的软锰矿1吨,理论上最多可制KMnO4____________吨。(保留到小数点后三位)
(6)利用电解法可得到更纯的KMnO4用惰性电极电解滤液Ⅱ。
①电解槽阳极反应式为________________________________。
②阳极还可能有气体产生,该气体是____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以Cl2、NaOH、(NH2)2CO(尿素)和SO2为原料可制备N2H4·H2O(水合肼)和无水Na2SO3,其主要实验流程如下:
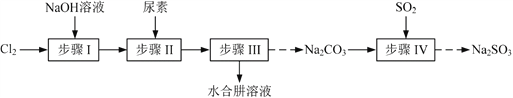
已知:①Cl2+2OH![]() ClO+Cl+H2O是放热反应。
ClO+Cl+H2O是放热反应。
②N2H4·H2O沸点约118 ℃,具有强还原性,能与NaClO剧烈反应生成N2。
(1)步骤Ⅰ制备NaClO溶液时,若温度超过40 ℃,Cl2与NaOH溶液反应生成NaClO3和NaCl,其离子方程式为____________________________________;实验中控制温度除用冰水浴外,还需采取的措施是____________________________________。
(2)步骤Ⅱ合成N2H4·H2O的装置如题19图1所示。NaClO碱性溶液与尿素水溶液在40 ℃以下反应一段时间后,再迅速升温至110 ℃继续反应。实验中通过滴液漏斗滴加的溶液是_____________;使用冷凝管的目的是_________________________________。

(3)步骤Ⅳ用步骤Ⅲ得到的副产品Na2CO3制备无水Na2SO3(水溶液中H2SO3、![]() 、
、![]() 随pH的分布如题19图2所示,Na2SO3的溶解度曲线如题19图3所示)。
随pH的分布如题19图2所示,Na2SO3的溶解度曲线如题19图3所示)。
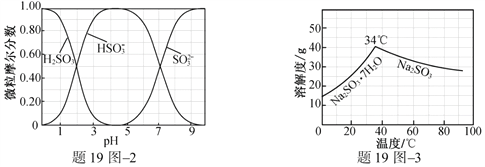
①边搅拌边向Na2CO3溶液中通入SO2制备NaHSO3溶液。实验中确定何时停止通SO2的实验操作为_________________。
②请补充完整由NaHSO3溶液制备无水Na2SO3的实验方案: _______________________,用少量无水乙醇洗涤,干燥,密封包装。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com