
| A. | 101kPa时,2H2(g)+O2(g)═2H2O(g);△H=-QkJ•mol-1,则H2的燃烧热为$\frac{1}{2}$QkJ•mol-1 | |
| B. | 同温同压下,H2(g)+Cl2(g)═2HCl(g)在光照和点燃条件下的△H相同 | |
| C. | 500℃、30MPa下,将0.5mol N2和1.5molH2置于密闭的容器中充分反应生成NH3(g),放热19.3kJ,其热化学方程式为: N2(g)+3H2(g)$?_{500℃,30MPa}^{催化剂}$2NH3(g)△H=-38.6kJ•mol-1 | |
| D. | H+(aq)+OH-(aq)═H2O(l);△H=-57.3kJ•mol-1,含1mol NaOH的氢氧化钠溶液与含0.5mol H2SO4的浓硫酸混合后放出57.3kJ的热量 |
分析 A.由燃烧的定义可知应生成液态水;
B.反应热与反应条件无关;
C.为可逆反应;
D.浓硫酸反应放出大量的热.
解答 解:A.燃烧热是生成液态水,故A错误;
B.反应热跟反应物和生成物能量有关,跟反应条件无关,故B正确;
C.此反应是可逆反应,19.3kJ是0.5mol N2和1.5molH2反应达平衡时的热量,但热化学方程式是1molN2(g)和3molH2(g)全部转化为2mol NH3(g)放出的热量比38.6kJ大,故C错误;
D.浓硫酸溶解放热,所以会放出大于57.3kJ的热量,故D错误.
故选B.
点评 本题考查化学反应与能量变化,为高频考点,侧重考查学生的分析能力,注意把握相关概念的理解,把握可逆反应的特点,难度不大.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
 用酸性氢氧燃料电池电解苦卤水(含Cl-、Br-、Na+、Mg2+)的装置如图所示(a,b为石墨电极).下列说法中正确的是( )
用酸性氢氧燃料电池电解苦卤水(含Cl-、Br-、Na+、Mg2+)的装置如图所示(a,b为石墨电极).下列说法中正确的是( )| A. | 电池工作时,正极反应式为O2+2H2O+4e-═4OH- | |
| B. | 电解时,电子流动路径是:负极-→外电路-→阴极-→溶液-→阳极-→正极 | |
| C. | 电解时,a电极周围首先放电的是Br-而不是Cl-,说明当其它条件相同时前者的还原性强于后者 | |
| D. | 当电池中消耗0.02g H2时,a极周围会产生0.02gH2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | FeCl2溶液中滴加氯水Fe2++Cl2═Fe3++2C1- | |
| B. | NaHCO3溶液水解:HCO3-+H2O?CO32-+H3O+ | |
| C. | 等体积、等浓度的稀氢氧化钡溶液与稀碳酸氢铵溶液混合:Ba2++2OH-+NH4++HCO3-═BaCO3↓+NH3•H2O+H2O | |
| D. | 少量CO2通人苯酚钠溶液中:2C6H5O-+CO2+H2O═2C6H5OH+CO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 反应速率用于衡量化学反应进行的快慢 | |
| B. | 决定反应速率的主要因素有浓度、压强、温度和催化剂 | |
| C. | 可逆反应达到化学平衡时,正、逆反应的速率都不为0 | |
| D. | 增大反应物浓度、提高反应温度都能增大反应速率 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 一定不含CH4和H2,可能含有NO2和NH3 | |
| B. | 一定含有CO,可能含HCl和CO2 | |
| C. | 只含有CO和HCl | |
| D. | 一定含CO和HCl,可能含CO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
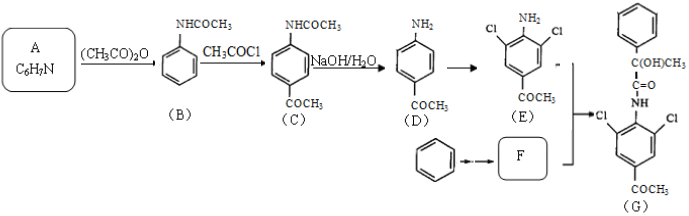 已知:
已知: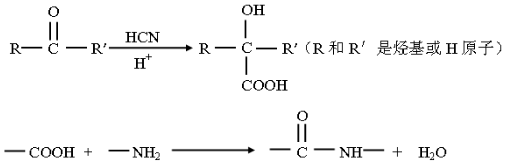
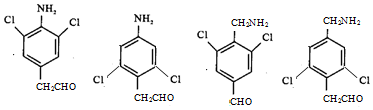
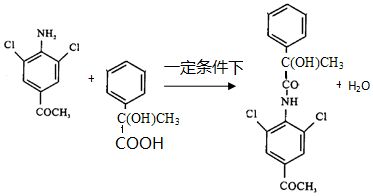
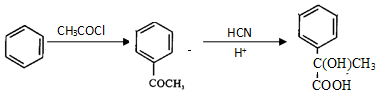 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 尿素是蛋白质代谢的产物,也是重要的化学肥料.工业合成尿素反应如下:
尿素是蛋白质代谢的产物,也是重要的化学肥料.工业合成尿素反应如下:| 温度(℃) | 15.0 | 20.0 | 25.0 | 30.0 | 35.0 |
| 平衡气体总浓度 (10-3mol/L) | 2.4 | 3.4 | 4.8 | 6.8 | 9.4 |

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 物质 | KCl | NaCl | K2Cr2O7 | Na2Cr2O7 | |
| 溶解度 (g/100g水) | 0℃ | 28 | 35.7 | 4.7 | 163 |
| 40℃ | 40.1 | 36.4 | 26.3 | 215 | |
| 80℃ | 51.3 | 38 | 73 | 376 | |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 用NA表示阿伏加德罗常数,下列说法正确的是( )
用NA表示阿伏加德罗常数,下列说法正确的是( )| A. | ③⑤⑥ | B. | ③⑤ | C. | ②④ | D. | ③④⑤ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com