
【题目】燃煤及工业废气中的SO2是形成酸雨的主要原因,消除SO2是减少酸雨形成的有效方法。完成下列问题:
(1)已知:4FeS2(s)+11O2(g)═2Fe2O3(s)+8SO2(g)△H=﹣3412.0kJmol﹣1
Fe2O3(s)+3CO(g)═2Fe(s)+3CO2(g)△H=﹣25.0 kJmol﹣1
2C(s)+O2(g)═2CO(g)△H=﹣221.0 kJmol﹣1
则2FeS2(s)+7O2(g)+3C(s)═2Fe(s)+3CO2(g)+4SO2(g)△H=_____kJmol﹣1。
(2)碱性NaClO2溶液脱硫法
SO2与碱性NaClO2溶液反应的离子方程式为2SO2+ClO2﹣+4OH﹣2SO42﹣+C1﹣+2H2O,已知pc=﹣lgc(SO2)。在刚性容器中,将含SO2的废气通入碱性NaClO2溶液中,测得pc与温度的关系如图所示。
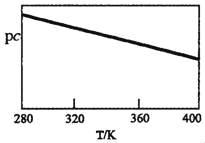
由图分析可知,该脱硫反应是_____反应(填“放热”或“吸热”);若温度不变,增大压强,该脱硫反应的平衡常数K_____(填“增大”、“减小”或“不变”)。
(3)燃料细菌脱硫法
①含FeS2的燃煤可用氧化亚铁硫杆菌(T.f)、氧化亚铁微螺菌(L.f)、氧化硫硫杆菌(T.t)进行脱硫,其脱硫过程如图所示:
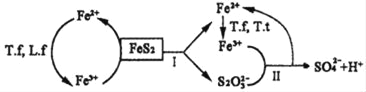
已知:脱硫总反应为:FeS2+14Fe3++8H2O═2SO42﹣+15Fe2++16H+,
Ⅰ反应的化学方程式为:FeS2+6Fe3++3H2O═S2O32﹣+7Fe2++6H+;
写出Ⅱ反应的化学方程式_____。
②在上述脱硫反应中,氧化亚铁硫杆菌(T.f)与Fe3+的形成过程可视为下图所示的原电池:

该细胞膜为_____(填“阳离子交换膜”或“阴离子交换膜”)。该电池的正极电极反应式为_____。该方法在高温下脱硫效率大大降低,原因是_____。
【答案】﹣2062.5 放热 不变 8Fe3++S2O32﹣+5H2O═2SO42﹣+8Fe2++10H+ 阳离子交换膜 O2+4H++4e﹣=2H2O 温度过高蛋白质发生变性,细菌失去催化能力 。
【解析】
(1)盖斯定律计算,利用同向相加、异向相减的原则;
(2)由图分析可知,升温平衡向吸热方向移动可知,对于平衡常数,如果是放热反应,随着温度上升,平衡常数减小;如果是吸热反应,随着温度上升,平衡常数上升;温度不变,K不变;
(3)①观察图像可知:反应Ⅱ是Fe3+和S2O32﹣反应生成亚铁离子和硫酸根离子,利用得失电子数相等、电荷守恒、原子守恒写出离子方程式;
②在脱硫反应中,氧化亚铁硫杆菌(T.f)与Fe3+的形成过程为如图所示的原电池反应,亚铁离子被氧化发生氧化反应在原电池负极反应,正极是氧气在酸性溶液中生成水,正极消耗氢离子,确定细胞膜为阳离子交换膜;温度过高蛋白质发生变性,细菌失去催化能力;
(1)已知:①4FeS2(s)+11O2(g)=2Fe2O3(s)+8SO2(g)△H=﹣3412.0kJmol﹣1
②Fe2O3(s)+3CO(g)=2Fe(s)+3CO2(g)△H=﹣25.0 kJmol﹣1
③2C(s)+O2(g)=2CO(g)△H=﹣221.0 kJmol﹣1
盖斯定律①×1/2+②+③×3/2计算 2FeS2(s)+7O2(g)+3C(s)=2Fe(s)+3CO2(g)+4SO2(g)△H=﹣2062.5KJ/mol;
答案:﹣2062.5。
(2)已知pc=﹣lgc(SO2),pc与温度的关系分析,温度越高Pc越小,则二氧化硫浓度增大,逆反应为吸热反应,正反应为放热反应,平衡常数只随温度变化,若温度不变,增大压强,该脱硫反应的平衡常数K不变;
答案:放热;不变。
(3)①反应Ⅱ是Fe3+和S2O32﹣反应生成亚铁离子和硫酸根离子,反应的离子方程式:8Fe3++S2O32﹣+5H2O═2SO42﹣+8Fe2++10H+;
答案:8Fe3++S2O32﹣+5H2O═2SO42﹣+8Fe2++10H+。
②脱硫反应中,氧化亚铁硫杆菌(T.f)与Fe3+的形成过程为如图所示的原电池反应,亚铁离子被氧化发生氧化反应在原电池负极反应,正极是氧气在酸性溶液中生成水,电极反应:O2+4H++4e﹣=2H2O,正极消耗氢离子,该细胞膜为阳离子交换膜,该方法在高温下脱硫效率大大降低,原因是:温度过高蛋白质发生变性,细菌失去催化能力;
答案:阳离子交换膜;O2+4H++4e﹣=2H2O;温度过高蛋白质发生变性,细菌失去催化能力。


 鹰派教辅衔接教材河北教育出版社系列答案
鹰派教辅衔接教材河北教育出版社系列答案 初中暑期衔接系列答案
初中暑期衔接系列答案科目:高中化学 来源: 题型:
【题目】(1)据科技日报网报道,南开大学科研团队借助镍和苯基硼酸共催化剂,首次实现烯丙醇高效、绿色合成。烯丙醇及其化合物可制成甘油、医药、农药、香料,合成维生素E和KI及天然抗癌药物紫杉醇中都含有关键的烯丙醇结构。丙烯醇的结构简式为CH2=CH-CH2OH。请回答下列问题:
①基态镍原子的价电子排布式为___________________。
②1 mol CH2=CH-CH2OH含____molσ键,烯丙醇分子中碳原子的杂化类型为________。
③ Ni2+能形成多种配离子,如[Ni(NH3)6]2+、[Ni(CN)2]2- 和[Ni(SCN)2]- 等,与CN-互为等电子体的分子为____________。
(2)乙炔是有机合成工业的一种原料。工业上曾用CaC2与水反应生成乙炔。
①CaC2中C22-与O22+互为等电子体,O22+的电子式可表示为_____________; lmol O22+中含有的π键数目为_______________。
②将乙炔通入[Cu(NH3)2]Cl溶液生成Cu2C2红棕色沉淀。Cu+基态核外电子排布式为____________。
③乙炔与氢氰酸反应可得丙烯腈(H2C=CH-C≡N)。丙烯腈分子中碳原子轨道杂化类型是_______________;分子中处于同一直线上的原子数目最多为_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在实验室中用二氧化锰跟浓盐酸反应制备干燥纯净的氯气.进行此实验,所用仪器如图:
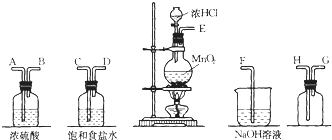
(1)连接上述仪器的正确顺序是:E接__,__接__,__接__,__接F。
(2)气体发生装置中进行的反应化学方程式是__;当0.5molMnO2参与反应时,生成的Cl2在标准状况下的体积约__。
(3)在装置中:①饱和食盐水的作用是__,②浓硫酸的作用是___。
(4)化学实验中检验是否有Cl2产生常用湿润的淀粉-KI试纸。如果有Cl2产生,可观察到的现象是___。
(5)写出尾气吸收装置中进行的反应的化学方程式__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.熔融NaCl能导电,是因为通电时NaCl发生了电离
B.NaCl固体不导电,因为NaCl固体中无带电微粒
C.NH4NO3电离时产生了NH![]() 、NO
、NO![]() ,无金属离子,所以NH4NO3不是盐
,无金属离子,所以NH4NO3不是盐
D.NaHSO4在水溶液中电离生成了Na+、H+、SO![]() 三种离子
三种离子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有下列反应:
①2H2O+Cl2+SO2=H2SO4+2HCl
②2KMnO4+16HCl(浓)=2KCl+2MnCl2+5Cl2↑+8H2O
针对上述两个反应回答:
(1)用单线桥标出①中电子转移的方向和数目_______________________________;
(2)写出②的离子化学方程式_____________________________________________;
(3)Cl2、H2SO4和KMnO4的氧化性由强到弱的顺序为________________________;
(4)反应②中氯化氢表现出的性质是________。
a.还原性 b.酸性 c.氧化性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知破坏1 mol A—A键、1 mol B—B键、1 mol A—B键时分别需要吸收436 kJ、498 kJ、463 kJ的能量。反应2A2+B2![]() 2A2B的能量变化关系如图所示。下列说法中错误的是( )。
2A2B的能量变化关系如图所示。下列说法中错误的是( )。
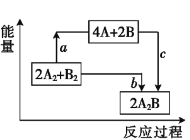
A. a=1370 kJB. b=482 kJ
C. 该反应是吸热反应D. 体系中A、B原子最活泼
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在中学化学中,KMnO4是常见的氧化剂之一。某实验小组收集整理了相关知识:
(1) KMnO4中Mn的化合价为_______。
(2) 实验室中可以加热分解KMnO4制取O2,其反应方程式为_______________。
(3) 实验中常在KMnO4溶液中加入适量稀硫酸,增加KMnO4的氧化性,但不宜用盐酸酸化,因为浓度较大时,KMnO4可能将Cl-氧化成Cl2,该反应中氧化剂和还原剂的物质的量之比为:____________ ,比较以下两种物质的氧化性:KMnO4_____________于Cl2(填“强”或“弱”)
(4) H2C2O4(草酸)是生物体的一种代谢产物,生活中常用作还原剂、除锈剂,将H2C2O4溶液滴入硫酸酸化的KMnO4溶液,当KMnO4被完全还原时,溶液颜色由_______变成无色,同时有无色气体生成。该反应方程式为:_____________________。
(5)某同学将KMnO4溶液加入H2O2溶液,却忘记了滴入稀硫酸,片刻后,有气泡产生,且出现黑色沉淀。该沉淀化学式为____________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】黄铁矿(主要成分为FeS2)的利用对资源和环境具有重要意义。
(1)工业上煅烧黄铁矿可制取SO2。已知下列热化学方程式
4FeS2(s)+11O2(g)=2Fe2O3(s)+8SO2(g) △H=akJ/mol
S(s)+O2(g)=SO2(g) △H=bkJ/mol
Fe(s)+2S(s)=FeS2(s) △H=ckJ/mol
则4Fe(s)+3O2(g)=2Fe2O3(s) △H=_____kJ/mol
(2)一种酸性条件下催化氧化黄铁矿的物质转化关系如图I所示。
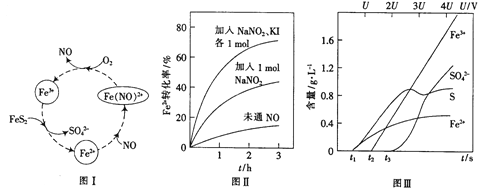
(1)写出如图中Fe3+与FeS2反应的离子方程式:______________。
(2)硝酸也可将FeS2氧化为Fe3+和SO42-,使用浓硝酸比使用稀硝酸反应速率慢,其原因是______________。
(3)控制Fe2+的浓度、溶液体积和通入O2的速率一定,图II所示为改变其他条件时Fe2+被氧化的转化率随时间的变化。
① 加入NaNO2发生反应:2H++3NO2-=NO3-+2NO+H2O。若1mol NaNO2完全反应则转移电子的数目为______mol。
② 加入NaNO2、KI发生反应:4H++2NO2-+2I-=2NO+I2+2H2O。解释图II中该条件下能进一步提高单位时间内Fe2+转化率的原因:______________。
(4)为研究FeS2作电极时的放电规律,以FeS2作阳极进行电解,由FeS2放电产生粒子的含量与时间、电压(U)的关系如图III所示。
①写出t1至t2间FeS2所发生的电极反应式:__________。
②当电压的值介于3U~4U之间,FeS2放电所得主要粒子为___________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com