
 (1)“天宫一号”于2011年9月在酒泉卫星发射中心发射,标志着我国的航空航天技术迈进了一大步.火箭的第一、二级发动机中,所用的燃料为偏二甲胼和四氧化二氮,偏二甲肼可用胼来制备.
(1)“天宫一号”于2011年9月在酒泉卫星发射中心发射,标志着我国的航空航天技术迈进了一大步.火箭的第一、二级发动机中,所用的燃料为偏二甲胼和四氧化二氮,偏二甲肼可用胼来制备.分析 (1)①依据热化学方程式和盖斯定律计算得到,
a、N2(g)+2O2(g)=N2O4(g)△H=10.7kJ•mol-1;
b、N2H4(g)+O2 (g)=N2(g)+2H2O(g)△H=-543kJ•mol-1,
由盖斯定律b×2-a得到;
②依据化学平衡移动原理和影响因素分析判断,2NO2=N2O4,反应是气体体积减小的放热反应;
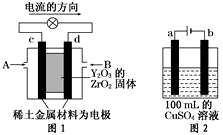
(2)①依据装置图中电流流向分析,c为正极,氧气的电子发生还原反应,d为负极,甲烷失电子发生氧化反应;
②图2是电解池,与电源正极连接的a电极为阳极,发生4OH--4e-═O2↑+2H2O,b为阴极,发生为Cu2++2e-═Cu,结合电极方程式计算,所得溶液电解过程中CuSO4溶液每损失2个Cu原子,就损失2个 O原子,相当于损失一个CuO,为了使CuSO4溶液,恢复原浓度,应加入CuO,也可以加入CuCO3,符合恢复溶液浓度的定量关系.
解答 解:(1)①a、N2(g)+2O2(g)=N2O4(g)△H=10.7kJ•mol-1;b、N2H4(g)+O2 (g)=N2(g)+2H2O(g)△H=-543kJ•mol-1
由盖斯定律b×2-a得到 2N2H4(g)+N2O4(g)=3N2(g)+4H2O(g)△H=-1096.7KJ/mol,
故答案为:2N2H4(g)+N2O4(g)=3N2(g)+4H2O(g)△H=-1096.7KJ/mol;
②四氧化二氮在大气中或在较高温度下很难稳定存在,它很容易转化为二氧化氮,由二氧化氮制取四氧化二氮,2NO2=N2O4,反应是放热反应,反应前后气体体积减小所以反应条件为:增大压强、降温都有利于反应正向进行;
故答案为:增大压强、降温.
(2)①图1是原电池,依据电流流向是从正极流向负极,c电极为正极,氧气得到电子发生还原反应,d电极为电池负极,甲烷失电子发生还原反应,在两极上分别通入CH4和空气,其中固体电解质是掺杂了Y2O3的ZrO2固体,它在高温下能传导阳极生成的O2-离子,负极电极反应为:CH4-8e-+4O2-=CO2↑+2H2O,
故答案为:正极,CH4-8e-+4O2-=CO2↑+2H2O;
②如图2所示电解100mL0.5mol•L-1CuSO4溶液,发生的电解池反应为:2CuSO4+2H2O$\frac{\underline{\;通电\;}}{\;}$2Cu+O2↑+2H2SO4,与电源正极相连的为阳极,溶液中 氢氧根离子失去电子发生氧化反应,电极反应为:4OH-═2H2O+O2↑+4e-;
若a电极产生56mL(标准状况)气体为氧气,物质的量为0.0025mol,消耗氢氧根离子物质的量为0.01mol,溶液中生成氢离子物质的量为0.01mol,c(H+)=$\frac{0.01mol}{0.1L}$=0.1mol/L,pH=-lg0.1=1;
则所得溶液电解过程中CuSO4溶液每损失2个Cu原子,就损失2个 O原子,相当于损失一个CuO,为了使CuSO4溶液,恢复原浓度,应加入CuO,也可以加入CuCO3,符合恢复溶液浓度的定量关系,但不能加入Cu(OH)2、Cu2(OH)2CO3,因为CuCO3+H2SO4═CuSO4+CO2↑+H2O,相当于加CuO,而Cu(OH)2+H2SO4═CuSO4+2H2O、Cu2(OH)2CO3+2H2SO4═2CuSO4 +CO2↑+3H2O,除增加溶质外还增加了水;故选ac.
故答案为:4OH-═2H2O+O2↑+4e-;1;ac.
点评 本题考查盖斯定律的计算应用,化学平衡的影响因素分析判断,原电池原理的应用,侧重于考查电极的判断和电解方程式的书写,注意平衡移动原理的分析,在注重对基础知识巩固和训练的同时,主要是侧重对学生能力的培养,有助于培养学生的逻辑思维能力和发散思维能力,提高学生灵活运用基础知识解决实际问题的能力.本题考查了盖斯定律的计算应用,化学平衡的影响因素分析判断,原电池原理的应用,侧重于考查电极的判断和电解方程式的书写,注意平衡移动原理的分析判断,题目难度中等.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:选择题

| A. | AB为气体,A2,B2均为气体 Q>0 | |
| B. | AB为气体,A2,B2其中有一种为气体,Q<0 | |
| C. | AB为气体,A2,B2其中有一种为气体,Q>0 | |
| D. | AB为气体,A2,B2其中至少有一种为气体,Q>0 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | C8H18(l)+$\frac{25}{2}$O2(g)═8CO2(g)+9H2O(g)△H=-48.40kJ•mol-1 | |
| B. | 2C8H18(l)+25O2(g)═16CO2(g)+18H2O(g)△H=+11035.2kJ•mol-1 | |
| C. | C8H18(l)+$\frac{25}{2}$O2(g)═8CO2(g)+9H2O(l)△H=+5517.6kJ•mol-1 | |
| D. | C8H18(l)+$\frac{25}{2}$O2(g)═8CO2(g)+9H2O(l)△H=-5517.6kJ•mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH3OH(l)+3/2O2(g)=CO2(g)+2H2O(l);△H=+725.8kJ/mol | |
| B. | 2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(g);△H=-1451.6kJ/mol | |
| C. | CH3OH(l)+3/2O2(g)=CO2(g)+2H2O(l);△H=-725.8kJ/mol | |
| D. | 2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(g);△H=+1451.6kJ/mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH3OH(l)+2O2(g)═CO2(g)+2H2O(l)△H=-2Q kJ•mol-1 | |
| B. | CH3OH(l)+2O2(g)═CO2(g)+2H2O(l)△H=-4Q kJ•mol-1 | |
| C. | CH3OH(l)+2O2(g)═CO2(g)+2H2O(l)△H=-Q kJ•mol-1 | |
| D. | CH3OH(l)+2O2(g)═CO2(g)+2H2O(g)△H=-4Q kJ•mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 合成氨工业对国民经济和社会发展具有重要的意义.对于密闭容器中的反应:N2(g)+3H2(g)?2NH3(g)(正反应为放热反应),673K、30MPa下n(NH3)和n(H2)随时间变化的关系如图所示.下列叙述正确的是( )
合成氨工业对国民经济和社会发展具有重要的意义.对于密闭容器中的反应:N2(g)+3H2(g)?2NH3(g)(正反应为放热反应),673K、30MPa下n(NH3)和n(H2)随时间变化的关系如图所示.下列叙述正确的是( )| A. | 点a的正反应速率比点b的大 | |
| B. | 点 c处反应达到平衡 | |
| C. | 点d(t1时刻) 和点e(t2时刻)处n(N2)不一样 | |
| D. | 其他条件不变,573K下反应至t1时刻,n(H2)比图中d点的值大 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 把锌粉改为锌粒 | B. | 水 | ||
| C. | 碳酸钠(固体) | D. | 降低反应体系温度 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com