
元素周期表中第ⅦA族元素的单质及其化合物的用途广泛。
(1)与氯元素同族的短周期元素的原子结构示意图为_________。
(2)能作为氯、溴、碘元素非金属性(原子得电子能力)递变规律的判断依据是________(填选项字母)。
a.Cl2、Br2、I2的熔点
b.Cl2、Br2、I2的氧化性
c.HCl、HBr、HI的热稳定性
d.HCl、HBr、HI的酸性
(3)工业上,通过如下转化可制得KClO3晶体:
NaCl溶液 NaClO3溶液
NaClO3溶液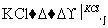 KClO3晶体
KClO3晶体
①完成Ⅰ中反应的总化学方程式: NaCl+
NaCl+ H2O===
H2O=== NaClO3+
NaClO3+ ________。
________。
②Ⅱ中转化的基本反应类型是__________,该反应过程能析出KClO3晶体而无其他晶体析出的原因是_________________。
(4)一定条件下,在水溶液中1 mol Cl-、ClO (x=1,2,3,4)的能量(kJ)相对大小如图所示。
(x=1,2,3,4)的能量(kJ)相对大小如图所示。

①D是________(填离子符号)。
②B―→A+C反应的热化学方程式为_______________________(用离子符号表示)。
解析 (1)根据题意可知,与Cl同族的短周期元素为F,其原子序数为9,最外层电子数为7,电子层数为2,故其原子结构示意图为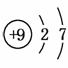 。
。
(2)比较元素的非金属性强弱可以通过比较元素的气态氢化物的稳定性或者最高价氧化物对应水化物的酸性,气态氢化物越稳定、最高价氧化物对应水化物的酸性越强,元素的非金属性越强,也可以通过单质之间的置换反应,故只有b、c正确。
(3)①NaCl中Cl元素的化合 价由-1价升高到NaClO3中的+5价,故必定有一种元素的化合价要降低,经分析只能是H元素由+1价降到0价,因此结合原子守恒和电子守恒可写出化学方程式:NaCl+3H2O===NaClO3+3H2↑。
价由-1价升高到NaClO3中的+5价,故必定有一种元素的化合价要降低,经分析只能是H元素由+1价降到0价,因此结合原子守恒和电子守恒可写出化学方程式:NaCl+3H2O===NaClO3+3H2↑。
②由NaClO3和KCl反应生成KClO3和NaCl,元素的化合价都没有变化故为复分解反应,其他晶体没有析出,只析出了KClO3,说明KClO3的溶解度较小,小于其他晶体。
(4)①根据图示曲线可知Cl元素的 化合价越来越高,由曲线可知D中Cl元素的化合价是+7价,因此ClO
化合价越来越高,由曲线可知D中Cl元素的化合价是+7价,因此ClO 中x=4,即D为ClO
中x=4,即D为ClO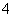 。
。
②根据曲线可知A为Cl-、B为ClO-,故化学方程式为3ClO-===2Cl-+ClO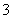 ,结合曲线可知ClO-相对Cl-的能量为60 kJ,ClO
,结合曲线可知ClO-相对Cl-的能量为60 kJ,ClO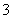 相对Cl-的能量为63 kJ,因此该反应的反应热为ΔH=(63-60)kJ·mol-1-2×60 kJ·mol-1=-117 kJ·mol-1。
相对Cl-的能量为63 kJ,因此该反应的反应热为ΔH=(63-60)kJ·mol-1-2×60 kJ·mol-1=-117 kJ·mol-1。
答案 (1)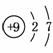
(2)bc
(3)①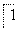 NaCl+
NaCl+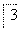 H2O===
H2O===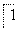 NaClO3+
NaClO3+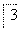 H2
H2 ↑
↑
②复分解反应 室温下,氯酸钾在水中的溶解度明显小于其他晶体
(4)①ClO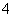
②3ClO-(aq)===ClO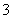 (aq)+2Cl-(aq)
(aq)+2Cl-(aq)
ΔH=-117 kJ·mol-1


 华东师大版一课一练系列答案
华东师大版一课一练系列答案科目:高中化学 来源: 题型:
某小组为研究原电池原理,设计如图装置,下列叙述正确的是
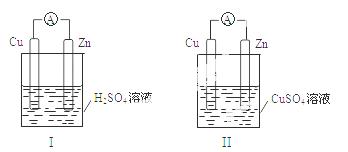
A.装置I,铜片上有O 2逸出
2逸出
B.装置I,锌片溶解,发生还原反应
C.装置II,电池反应为:Zn+ Cu2+= Zn2++ Cu
D.装置II,外电路中,电子从锌电极流向铜电极
查看答案和解析>>
科目:高中化学 来源: 题型:
固体氧化物燃料电池是由美国西屋(Westinghouse)公司研制开发的.它以固体氧化锆—氧化钇为电解质,
这种固体电解质在高温下允许氧离子(O2-)在其间通过.该电池的工作原理如下图所示,其中多孔电极a、b
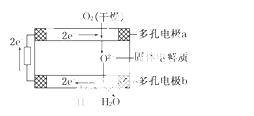 均不参与电极反应.下列判断正确的是
均不参与电极反应.下列判断正确的是
A.有O2放电的a极为电池的负极
B.有H2放电的b极为电池的负极
C.a极对应的电极反应为O2+2H2O+4e-===4OH-
D.b极对应的电极反应为2H2-4e-+4OH-===4H2 O
O
查看答案和解析>>
科目:高中化学 来源: 题型:
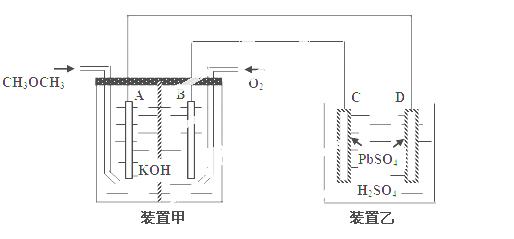
下图中,甲装置为CH3OCH3、O2、KOH三者构成的燃烧电池,其电极均为Pt电极。装置乙中,C、D电极为Pb电极,其表面均覆盖着PbSO4,其电解液为稀H2SO4溶液。
① 写出甲装置中A极的电极反应式___________________________________________
② 写出乙装置中C极的电极反应式___________________________________________
③ 当有23克甲醚参加反应时,D电极的质量变化为______克。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列化学实验事实及其结论都正确的是( )
| 选项 | 实验事实 | 结论 |
| A | 将SO2通入含HClO的溶液中生成H2SO4 | HClO酸性比H2SO4强 |
| B | 铝箔在酒精灯火焰上加热熔化但不滴落 | 铝箔表面氧化铝熔点高于铝 |
| C | SiO2可以和NaOH溶液及HF溶液反应 | SiO2属于两性氧化物 |
| D | 将SO2通入溴水中,溴水褪色 | SO2具有漂白性 |
查看答案和解析>>
科目:高中化学 来源: 题型:
短周期元素X、Y、Z、W 的原子序数依次增大,且原子最外层电子数之和为13。X 的
原子半径比Y 的小,X 与W 同主族,Z 是地壳中含量最高的元素。下列说法正确的是( )
A.原子半径的大小顺序: r(Y)>r(Z)>r(W)
B.元素Z、W 的简单离子的电子层结构不同
C.元素Y 的简单气态氢化物的热稳定性比Z 的强
D.只含X、Y、Z 三种元素的化合物,可能是离子化合物,也可能是共价化合物
查看答案和解析>>
科目:高中化学 来源: 题型:
下列关于元素周期表的叙述,不正确的是 ( )
A.共有7个周期,16个族
B.形成化合物种类最多的元素在第二周期
C.第ⅡA族的右边是第ⅢB族,第ⅢA族的左边是第ⅡB族
D.某主族元素最高价氧化物对应的水化物的化学式为HnROm,其气态氢化物的化学式一定为H2m-nR或RH2m-n
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com