
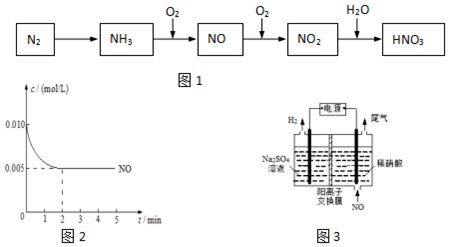
分析 氮气和氢气合成氨,氨气催化氧化生成一氧化氮和水,一氧化氮和氧气反应生成二氧化氮,二氧化氮和水反应生成硝酸和一氧化氮,
(1)NH3和O2在催化剂作用下反应生成一氧化氮和水;
(2)①结合图象NO浓度的变化计算v(NO),结合反应速率之比等于化学计量数之比计算v(O2);
②计算各物质的平衡浓度,结合K=$\frac{{c}^{2}(N{O}_{2})}{{c}^{2}(NO)c({O}_{2})}$计算;
③结合能量变化书写和计算反应的热化学方程式,与ii通过盖斯定律计算得到2NO+O2=2NO2反应的热化学方程式分析判断;
(3)一氧化氮失电子生成硝酸,结合电荷守恒和原子守恒配平书写电极反应;
解答 解;(1)NH3和O2在催化剂作用下反应生成一氧化氮和水,反应的化学方程式为:4NH3+5O2$\frac{\underline{催化剂}}{△}$ 4NO+6H2O,
故答案为:4NH3+5O2$\frac{\underline{催化剂}}{△}$ 4NO+6H2O;
(2)①由图象可知NO浓度的变化计算v(NO)=$\frac{0.010mol/L-0.005mol/L}{2min}$=0.025mol/(L•min),则v(O2)=$\frac{1}{2}$v(NO)=1.25×10-3mol/(L•min),
故答案为:1.25×10-3;
②2NO(g)+O2(g)?2NO2(g)
起始 0.01 0.005 0
平衡 0.005 0.0025 0.005
则k=$\frac{{c}^{2}(N{O}_{2})}{{c}^{2}(NO)c({O}_{2})}$=$\frac{0.00{5}^{2}}{0.00{5}^{2}×0.0025}$=400,
故答案为:400;
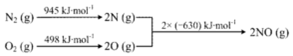
③i.N2(g)+O2(g)=2NO(g)△H=(945KJ/mol+498KJ/mol)-2×630KJ/mol=+183KJ/mol,
ii.N2(g)+2O2(g)═2NO2(g)△H=+68kJ•mol-1
则盖斯定律ii-i得到2NO(g)+O2(g)=2NO2(g)△H=-115 kJ•mol-1,温度升高,平衡向逆反应方向移动,NO转化为NO2的平衡转化率降低,
故答案为:2NO(g)+O2(g)=2NO2(g)△H=-115 kJ•mol-1,温度升高,平衡向逆反应方向移动,NO转化为NO2的平衡转化率降低;
(3)电解过程中NO转化为硝酸的电极反应式为:NO-3e-+2H2O═NO3-+4H+,
故答案为:NO-3e-+2H2O═NO3-+4H+;
点评 本题考查了物质制备、化学反应速率和平衡常数的计算、热化学方程式书写、电解原理等知识点,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 16Q | B. | 8Q | C. | 4Q | D. | 2Q |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙醇、乙酸互为同分异构体 | |
| B. | 乙醇、乙酸都能氧化为乙醛 | |
| C. | 乙醇、乙酸都能与NaOH浓液反应 | |
| D. | 乙醇、乙酸可以用紫色石蕊浓液来鉴別 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 物质类别 | 金属氧化物 | 碱 | 盐 |
| 化学式 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 铜和浓硝酸反应生成红棕色气体:Cu+4H++2NO3-=Cu2++2NO2↑+2H2O | |
| B. | 向NaHCO3溶液中加入过量的澄清石灰水:2HCO3-+Ca2++2OH-═CaCO3↓+CO32-+2H2O | |
| C. | 向漂白液中加入适量洁厕灵(含盐酸),产生氯气:ClO-+Cl-+2H+═Cl2↑+H2O | |
| D. | 向澄清的苯酚钠溶液中通入CO2,变浑浊: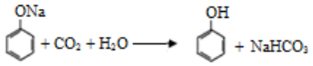 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
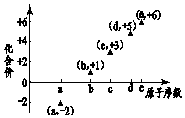 图是部分短周期元素的原子序数与其某种常见化合价的关系图,若用原子序数代表所对应的元素,则下列说法正确的是( )
图是部分短周期元素的原子序数与其某种常见化合价的关系图,若用原子序数代表所对应的元素,则下列说法正确的是( )| A. | 31d和33d互为同素异形体 | B. | 气态氢化物的稳定性:a>d>e | ||
| C. | 工业上常用电解法制备单质b和c | D. | a和b形成的化合物不可能含共价键 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向CH3COONa溶液中加入盐酸至pH=7:c(Na+)=c(Cl-)+c(CH3COO-) | |
| B. | 向NaHCO3中滴入NaOH溶液至反应完全:c(Na+)=2[c(HCO3-)+c(CO32-)+c(H2CO3)] | |
| C. | 向氨水中加入少量NH4Cl固体:$\frac{c(N{H}_{4}^{+})}{c(N{H}_{3}•{H}_{2}O)}$增大 | |
| D. | 向NaHSO4溶液中加入等浓度等体积的Ba(OH)2溶液:pH=13 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 4HNO3(浓)+S$\frac{\underline{\;\;△\;\;}}{\;}$SO2↑+4NO2↑+2H2O | B. | HNO3+NaOH=NaNO3+H2O | ||
| C. | 2HNO3+CuO=Cu(NO3)2+H2O | D. | 2HNO3+CaCO3=Ca(NO3)2+CO2↑+H2O |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com