
| A、a<c<0 |
| B、b>d>0 |
| C、2a=b<0 |
| D、2c=d>0. |


科目:高中化学 来源: 题型:
| A、19.56% | B、20% |
| C、22% | D、25% |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、NaOH 溶液 |
| B、氢氧化钡溶液 |
| C、氨水溶液 |
| D、澄清石灰水 |
查看答案和解析>>
科目:高中化学 来源: 题型:
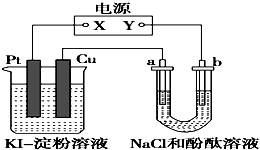 CuI是一种不溶于水的白色固体,它可以由反应:2Cu2++4I-═2CuI↓+I2而得到.如图所示装置中,a、b都是惰性电极,通电一段时间后,在KI淀粉溶液中阳极周围变蓝色,则下列说法正确的是( )
CuI是一种不溶于水的白色固体,它可以由反应:2Cu2++4I-═2CuI↓+I2而得到.如图所示装置中,a、b都是惰性电极,通电一段时间后,在KI淀粉溶液中阳极周围变蓝色,则下列说法正确的是( )| A、若a极变红,则在Pt电极上:2I--2e-═I2,淀粉遇碘变蓝 |
| B、若b极变红,则在Pt电极上:4OH--4e-═2H2O+O2↑,O2将I-氧化为I2,淀粉遇碘变蓝 |
| C、若a极变红,则在Cu电极上:2Cu+4I--4e-═2CuI↓+I2,碘遇淀粉变蓝 |
| D、若b极变红,则在Cu极上:Cu-2e-═Cu2+,Cu2+显蓝色 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、v (A)=0.5 mol/(L?s) |
| B、v (B)=0.9 mol/(L?s) |
| C、v (C)=0.8 mol/(L?s) |
| D、v (D)=1.0 mol/(L?s) |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、燃烧白磷放出的能量比燃烧红磷放出的能量多 |
| B、白磷转化为红磷是属于放热反应 |
| C、白磷和红磷互为同素异形体 |
| D、等质量的白磷和红磷,白磷含有的能量比红磷的低 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、其他条件不变,增大某一反应物浓度,反应物的转化率一定都增大 |
| B、对于有气体参加的反应,其他条件不变增大压强,体积缩小,体系中各气体的浓度一定增大 |
| C、对于有气体参加的反应,改变压强使平衡向右移动,生成的气体的浓度一定增大 |
| D、增大反应物的浓度,平衡向右移动,生成物的体积分数一定增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、工业用电解熔融AlCl3的方法制金属铝 |
| B、铅蓄电池工作时,正极反应为:PbO2+2e-+4H++SO42-=PbSO4+2H2O |
| C、电解饱和食盐水时,用铁作阳极,Cl- 发生氧化反应 |
| D、电解精炼铜时,阳极泥中含有Zn、Fe、Ag、Au等金属 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com