
| A、pH=7的溶液 | ||
| B、c(H+)=10-7 mol?L-1的溶液 | ||
C、
| ||
| D、氨水和硫酸铵的混合液中c(NH4+)=2c(SO42-) |
| c(H+) |
| c(OH-) |


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
| A、0.10mol/L |
| B、0.15 mol/L |
| C、0.20 mol/L |
| D、0.25 mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:

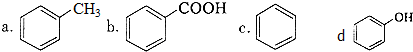
 )是一种重要的有机化工原料.
)是一种重要的有机化工原料.
 .
. 的合成路线流程图(无机试剂任用).
的合成路线流程图(无机试剂任用).| HBr |
| NaOH溶液 |
| △ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、①⑦ | B、②⑦ | C、③④ | D、④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:



查看答案和解析>>
科目:高中化学 来源: 题型:
 正丁醛是一种化工原料.某实验小组利用如图装置合成正丁醛.
正丁醛是一种化工原料.某实验小组利用如图装置合成正丁醛.| Na2Cr2O7 |
| H2SO4△ |
| 沸点/.c | 密度/(g?cm-3) | 水中溶解性 | |
| 正丁醇 | 111.72 | 0.8109 | 微溶 |
| 正丁醛 | 75.7 | 0.8017 | 微溶 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、由水电离出的c(H+)=1×10-14mol/L的溶液中:K+、I-、Cl-、NO3- |
| B、在呈中性的溶液中:Al3+、Na+、CO32-、Cl- |
| C、在pH=12的溶液中 NH4+、Na+、SO42-、Cl- |
| D、在c(H+)=0.1 mol?L-1的溶液中Fe3+、K+、Cl-、NO3- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com