
|
Na2S溶液中存在多种粒子,下列各粒子间的关系正确的是 | |
| [ ] | |
A. |
c(Na+)>c(S2-)>c(OH-)>c(HS-)>c(H+) |
B. |
c(Na+)+c(H+)=c(S2-)+c(HS-)+c(OH-) |
C. |
c(Na+)=c(HS-)+2c(H2S)+2c(S2-) |
D. |
c(OH-)=c(H+)+c(HS-)+2c(H2S) |
|
电解质的水溶液中存在两个守恒:①物料守恒,②电荷守恒.通俗地说:①任何一种元素的粒子数既不能增加也不会减少;②电解质溶液中存在各种带电的粒子,但所带电荷量的代数和等于零,即溶液不带电.结合本题有如下两个等式(在同一体积中,用浓度表示即可): 物料守恒:c(Na+)=2c(HS-)+2c(H2S)+2c(S2-)① 电荷守恒:c(Na+)+c(H+)=2c(S2-)+c(HS-)+c(OH-)② 在物料守恒中,应该找出该元素可能转化生成的各种粒子.如本题的硫元素,它来源于Na2S中的S2-,少量的S2-要水解转化成HS-,微量的HS-进一步水解转化成H2S.所以含硫元素的各种粒子总数与钠离子的粒子数之比应符合原化学式中粒子的比值. 在电荷守恒中,如何计算带多个单位电荷的粒子所带电荷量,往往容易出现误解. 浓度只表示该粒子在单位体积里其物质的量(粒子)的多少,并不表示它带电荷量的多少.用其所带电荷数乘以其浓度,等于其所带电荷量. D为溶液中的质子守恒,正确. |


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
 硫及其化合物在自然界中广泛存在,运用相关原理回答下列问题:
硫及其化合物在自然界中广泛存在,运用相关原理回答下列问题:
查看答案和解析>>
科目:高中化学 来源:2013-2014学年江西省高三高考模拟理综化学试卷(解析版) 题型:填空题
硫酸盐主要来自地层矿物质,多以硫酸钙、硫酸镁的形态存在。
(1)已知:①Na2SO4(s)=Na2S(s)+2O2(g) ; ΔH1= +1011.0 kJ · mol-1
②C(s)+O2(g)=CO2(g) ; ΔH2=-393.5 kJ · mol-1
③2C(s)+O2(g)=2CO(g) ; ΔH3=-221.0 kJ · mol-1
则反应④Na2SO4(s)+4C(s)=Na2S(s)+4CO(g);ΔH4= kJ · mol-1,该反应能自发进行的原因是 ;工业上制备Na2S不用反应①,而用反应④的理由是 。
(2)已知不同温度下2SO2+O2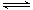 2SO3的平衡常数见下表。
2SO3的平衡常数见下表。
|
温度(℃) |
527 |
758 |
927 |
|
平衡常数 |
784 |
1.0 |
0.04 |
1233℃时,CaSO4热解所得气体的主要成分是SO2和O2,而不是SO3的原因是 。
(3)高温时,用CO还原MgSO4可制备高纯MgO。
①750℃时,测得气体中含等物质的量SO2和SO3,此时反应的化学方程式是 。
②将上述反应获得的SO2通入含PtCl42-的酸性溶液,可还原出Pt,则反应的离子方程式是 。
③由MgO可制成“镁—次氯酸盐”燃料电池,其装置示意图如图,则正极的电极反应式为 。

查看答案和解析>>
科目:高中化学 来源:2012-2013学年山东省威海市高三5月模拟考试化学试卷(解析版) 题型:简答题
硫及其化合物在自然界中广泛存在,运用相关
原理回答下列问题:
(1)如图表示一定温度下,向体积为10L的密闭容器中充入1molO2和一定量的SO2后,SO2和SO3(g)的浓度随时间变化的情况。
①该温度下,从反应开始至平衡时氧气的平均反应速率是 ;
②该温度下,反应2SO2(g)+O2(g) 2SO3(g)的平衡常数为 。
(2)以黄铜矿(主要成分CuFeS2)为原料,经焙烧、熔炼等使铁元素及其他有关杂质进入炉渣,将铜元素还原为铜。发生的主要反应为:
2Cu2S(s)+3O2(g) = 2Cu2O(s)+2SO2(g) △H =-768.2 kJ·mol-1
2Cu2O(s)+ Cu2S (s) = 6Cu(s)+SO2(g) △H =+116.0 kJ·mol-1
①“焙烧”时,通入少量空气使黄铜矿部分脱硫生成焙砂(主要成分是Cu2S和FeS,其物质的量比为1:2)和SO2,该反应的化学方程式为: 。
②在熔炼中,Cu2S与等物质的量的O2反应生成Cu的热化学方程式为: 。
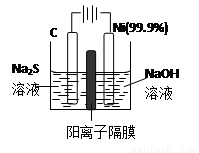
(3)用电解的方法将硫化钠溶液氧化为多硫化物的研究具有重要的实际意义,将硫化物转变为多硫化物是电解法处理硫化氢废气的一个重要内容。
如图,是电解产生多硫化物的实验装置:
①已知阳极的反应为:(x+1)S2-=SxS2-+2xe-,则阴极的电极反应式是: 。
当反应转移xmol电子时,产生的气体体积为 (标准状况下)。
②将Na2S·9H2O溶于水中配制硫化物溶液时,通常是在氮气气氛下溶解。其原因是(用离子反应方程式表示): 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com