
| A、强的氧化性 | B、碱性 |
| C、还原性 | D、两性 |
科目:高中化学 来源: 题型:
| A、150mL3mol?L-1 NaCl溶液 |
| B、25mL3mol?L-1 MgCl2溶液 |
| C、150mL3mol?L-1 KClO3溶液 |
| D、75mL2mol?L-1 FeCl3溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、该溶液中的溶质不可能是NaHSO4 | ||
| B、向该溶液中加入铝粉,一定能产生大量H2 | ||
C、下列离子在该溶液中一定能大量共存:Ca2+、Cl-、K+、NO
| ||
| D、向该溶液中加入NaHCO3,一定有化学反应发生 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、由甲苯氧化制苯甲酸;苯与浓硝酸、浓硫酸混合共热制取硝基苯 |
| B、丙烯与溴水反应;乙炔一定条件下与氯化氢反应生成氯乙烯 |
| C、乙炔一定条件下反应生成苯;溴乙烷和NaOH醇溶液共热 |
| D、乙醇与浓硫酸共热至170℃生成乙烯; 乙醇与浓硫酸共热至140℃生成乙醚 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、KH中H是-1价 |
| B、该反应转移的电子数为2个 |
| C、H2是氧化产物,也是还原产物 |
| D、KH可以在野外生存时做应急生氢药品 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 1 |
| 2 |
| 1 |
| 2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 (1)已知下列两个热化学方程式:
(1)已知下列两个热化学方程式:查看答案和解析>>
科目:高中化学 来源: 题型:
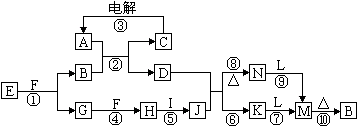
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com